Urani: diferència entre les revisions
| Línia 200: | Línia 200: | ||
Els [[bromur]]s i [[iodur]]s d'urani es formen mitjançant la reacció directa de [[brom]] i [[iode]] amb urani, respectivament, o bé afegint {{quím|UH|3}} als àcids d'aquests elements.<ref name="EncyChem782"/> Alguns exemples coneguts són el {{quím|UBr|3}}, el {{quím|UBr|4}}, el {{quím|UI|3}} i el {{quím|UI|4}}. Els oxohalurs d'urani són solubles en aigua i inclouen els següents compostos: {{quím|UO|2|F|2}}, {{quím|UOCl|2}}, {{quím|UO|2|Cl|2}} i {{quím|UO|2|Br|2}}. L'estabilitat dels oxohalurs decreix amb l'augment del [[pes atòmic]] del component halur.<ref name="EncyChem782"/> |
Els [[bromur]]s i [[iodur]]s d'urani es formen mitjançant la reacció directa de [[brom]] i [[iode]] amb urani, respectivament, o bé afegint {{quím|UH|3}} als àcids d'aquests elements.<ref name="EncyChem782"/> Alguns exemples coneguts són el {{quím|UBr|3}}, el {{quím|UBr|4}}, el {{quím|UI|3}} i el {{quím|UI|4}}. Els oxohalurs d'urani són solubles en aigua i inclouen els següents compostos: {{quím|UO|2|F|2}}, {{quím|UOCl|2}}, {{quím|UO|2|Cl|2}} i {{quím|UO|2|Br|2}}. L'estabilitat dels oxohalurs decreix amb l'augment del [[pes atòmic]] del component halur.<ref name="EncyChem782"/> |
||
== Isòtops == |
== Isòtops ===== Concentracions naturals === |
||
{{traducció|en|Uranium}} |
|||
=== Concentracions naturals === |
|||
{{AP|Isòtops de l'urani}} |
{{AP|Isòtops de l'urani}} |
||
L'[[urani natural]] està format per tres [[isòtop]]s principals: l'[[urani-238]] (amb una [[abundància natural]] del 99,28%), l'[[urani-235]] (0,71%) i l'[[urani-234]] (0,0054%). Tots tres isòtops són [[radioactivitat|radioactius]] –emeten [[partícula alfa|partícules alfa]]–, i també tots tres tenen poques probabilitats de patir [[fissió espontània]] en comptes d'[[emissió alfa]]. |
L'[[urani natural]] està format per tres [[isòtop]]s principals: l'[[urani-238]] (amb una [[abundància natural]] del 99,28%), l'[[urani-235]] (0,71%) i l'[[urani-234]] (0,0054%). Tots tres isòtops són [[radioactivitat|radioactius]] –emeten [[partícula alfa|partícules alfa]]–, i també tots tres tenen poques probabilitats de patir [[fissió espontània]] en comptes d'[[emissió alfa]]. |
||
| Línia 224: | Línia 221: | ||
El procés de [[centrifugadora de gas|centrifugació de gas]], en el qual se separa l'[[hexafluorur d'urani]] ({{chem|UF|6}}) gràcies a la diferència de [[pes molecular]] entre el <sup>235</sup>UF<sub>6</sub> i el <sup>238</sup>UF<sub>6</sub> mitjançant centrifugadores d'alta velocitat, és el procés d'enriquiment més barat i més utilitzat.<ref name="BuildingBlocks478">{{Harvnb|Emsley|2001|p=478}}</ref> D'altra banda, el procés de [[difusió gasosa]] havia estat anteriorment el mètode principal d'enriquiment; de fet, fou utilitzat en el [[Projecte Manhattan]]. En aquest procés, l'hexafluorur d'urani és [[difusió|difós]] repetidament a través d'una membrana de plata-zinc, i els diferents isòtops de l'urani són separats gràcies a la taxa de difusió (com que l'urani-238 és més pesat, la seva difusió és una mica més lenta que la de l'urani-235).<ref name="BuildingBlocks478"/> El mètode de [[separació isotòpica mitjançant làser molecular]] fa servir un raig làser d'energia precisa per trencar l'enllaç entre l'urani-235 i el fluor, la qual cosa deixa l'urani-238 enllaçat amb el fluor i permet la [[precipitació]] del metall urani-235.<ref name="BuildingBlocks479"/> Un mètode alternatiu d'enriquiment amb làser es coneix com [[separació isotòpica mitjançant làser de vapor atòmic]], i fa servir [[làser regulable|làsers regulables]] tals com els [[làser de colorant|làsers de colorant]].<ref>{{cite book |editor=[[F. J. Duarte|Duarte, F. J.]] i Hillman, L. W. |title=Dye Laser Principles |year=1990 |page = 413 |isbn = 0-12-222700-X |url=http://www.opticsjournal.com/dlp.htm}}</ref> Un altre mètode utilitzat és la difusió tèrmica líquida.<ref name="SciTechEncy"/> |
El procés de [[centrifugadora de gas|centrifugació de gas]], en el qual se separa l'[[hexafluorur d'urani]] ({{chem|UF|6}}) gràcies a la diferència de [[pes molecular]] entre el <sup>235</sup>UF<sub>6</sub> i el <sup>238</sup>UF<sub>6</sub> mitjançant centrifugadores d'alta velocitat, és el procés d'enriquiment més barat i més utilitzat.<ref name="BuildingBlocks478">{{Harvnb|Emsley|2001|p=478}}</ref> D'altra banda, el procés de [[difusió gasosa]] havia estat anteriorment el mètode principal d'enriquiment; de fet, fou utilitzat en el [[Projecte Manhattan]]. En aquest procés, l'hexafluorur d'urani és [[difusió|difós]] repetidament a través d'una membrana de plata-zinc, i els diferents isòtops de l'urani són separats gràcies a la taxa de difusió (com que l'urani-238 és més pesat, la seva difusió és una mica més lenta que la de l'urani-235).<ref name="BuildingBlocks478"/> El mètode de [[separació isotòpica mitjançant làser molecular]] fa servir un raig làser d'energia precisa per trencar l'enllaç entre l'urani-235 i el fluor, la qual cosa deixa l'urani-238 enllaçat amb el fluor i permet la [[precipitació]] del metall urani-235.<ref name="BuildingBlocks479"/> Un mètode alternatiu d'enriquiment amb làser es coneix com [[separació isotòpica mitjançant làser de vapor atòmic]], i fa servir [[làser regulable|làsers regulables]] tals com els [[làser de colorant|làsers de colorant]].<ref>{{cite book |editor=[[F. J. Duarte|Duarte, F. J.]] i Hillman, L. W. |title=Dye Laser Principles |year=1990 |page = 413 |isbn = 0-12-222700-X |url=http://www.opticsjournal.com/dlp.htm}}</ref> Un altre mètode utilitzat és la difusió tèrmica líquida.<ref name="SciTechEncy"/> |
||
== Exposició humana == |
|||
{{traducció|en|Uranium}} |
|||
A person can be exposed to uranium (or its radioactive daughters such as [[radon]]) by inhaling dust in air or by ingesting contaminated water and food. The amount of uranium in air is usually very small; however, people who work in factories that process [[phosphate]] [[fertilizer]]s, live near government facilities that made or tested nuclear weapons, live or work near a modern battlefield where depleted uranium [[weapons]] have been used, or live or work near a [[coal]]-fired power plant, facilities that mine or process uranium ore, or enrich uranium for reactor fuel, may have increased exposure to uranium.<ref name="EPA-Rad">{{cite web |url=http://www.epa.gov/radiation/radionuclides/uranium.html |accessdate=31 July 2009 |title=Radiation Information for Uranium |publisher=U.S. Environmental Protection Agency}}</ref><ref name="ATSDR-ToxFAQ">{{cite web |url=http://www.atsdr.cdc.gov/tfacts150.html |title=ToxFAQ for Uranium |publisher=Agency for Toxic Substances and Disease Registry |month=September |year=1999 |accessdate=18 February 2007}}</ref> Houses or structures that are over uranium deposits (either natural or man-made slag deposits) may have an increased incidence of exposure to radon gas. |
|||
Most ingested uranium is excreted during [[digestion]]. Only 0.5% is absorbed when insoluble forms of uranium, such as its oxide, are ingested, whereas absorption of the more soluble [[uranyl]] ion can be up to 5%.<ref name="BuildingBlocks477"/> However, soluble uranium compounds tend to quickly pass through the body whereas insoluble uranium compounds, especially when inhaled by way of dust into the [[lung]]s, pose a more serious exposure hazard. After entering the bloodstream, the absorbed uranium tends to [[bioaccumulation|bioaccumulate]] and stay for many years in [[bone]] tissue because of uranium's affinity for phosphates.<ref name="BuildingBlocks477"/> Uranium is not absorbed through the skin, and [[alpha particle]]s released by uranium cannot penetrate the skin. |
|||
Incorporated uranium becomes [[uranyl]] ions, which accumulate in bone, liver, kidney, and reproductive tissues. Uranium can be decontaminated from steel surfaces<ref name=Francis>{{cite journal |pmid=16053105 |year=2005 |last1=Francis |first1=AJ |last2=Dodge |first2=CJ |last3=McDonald |first3=JA |last4=Halada |first4=GP |title=Decontamination of uranium-contaminated steel surfaces by hydroxycarboxylic acid with uranium recovery |volume=39 |issue=13 |pages=5015–21 |journal=Environmental Science & Technology |doi=10.1021/es048887c|bibcode = 2005EnST...39.5015F }}</ref> and [[aquifer]]s.<ref name=Wu>{{cite journal |pmid=16830572 |year=2006 |last1=Wu |first1=WM |last2=Carley |first2=J |last3=Gentry |first3=T |last4=Ginder-Vogel |first4=MA |last5=Fienen |first5=M |last6=Mehlhorn |first6=T |last7=Yan |first7=H |last8=Caroll |first8=S |last9=Pace |first9=MN |displayauthors=8|title=Pilot-scale in situ bioremedation of uranium in a highly contaminated aquifer. 2. Reduction of u(VI) and geochemical control of u(VI) bioavailability |volume=40 |issue=12 |pages=3986–95 |journal=Environmental Science & Technology |doi=10.1021/es051960u|bibcode = 2006EnST...40.3986W }}</ref> |
|||
===Efectes i precaucions=== |
|||
Normal functioning of the [[kidney]], [[brain]], [[liver]], [[heart]], and other systems can be affected by uranium exposure, because, besides being weakly radioactive, uranium is a [[toxic metal]].<ref name="BuildingBlocks477"/><ref name=Craft04>{{cite journal |
|||
| title = Depleted and natural uranium: chemistry and toxicological effects |
|||
| author = Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L. and Abou-Donia, M. B. |
|||
| journal = Journal of Toxicology and Environmental Health Part B: Critical Reviews |
|||
| year = 2004 |
|||
| volume = 7 |
|||
| issue = 4 |
|||
| pmid = 15205046 |
|||
| pages = 297–317 |
|||
| doi = 10.1080/10937400490452714}}</ref><ref name="ATSDR">{{cite web |title=Toxicological Profile for Uranium |url=http://www.atsdr.cdc.gov/toxprofiles/tp150-c2.pdf |publisher=Agency for Toxic Substances and Disease Registry (ATSDR) |location=Atlanta, GA| id=CAS# 7440-61-1 |month=September |year=1999 |format=PDF}}</ref> Uranium is also a reproductive toxicant.<ref name="Hindin2005">{{cite journal |doi = 10.1186/1476-069X-4-17 |last1 = Hindin |first1 = Rita|last2 = Brugge |year = 2005 |first2 = D |last3 = Panikkar |first3 = B |title = Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective |journal = Environ Health |volume = 4 |page = 17 |pmid = 16124873|pmc = 1242351}}</ref><ref>{{cite journal |
|||
| author = Arfsten, D.P.; K.R. Still; G.D. Ritchie |
|||
| year = 2001 |
|||
| title = A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development |
|||
| journal = Toxicology and Industrial Health |
|||
| volume = 17 |
|||
| pages = 180–91 |
|||
| doi = 10.1191/0748233701th111oa |
|||
| issue = 5–10 |
|||
| pmid = 12539863}}</ref> Radiological effects are generally local because alpha radiation, the primary form of <sup>238</sup>U decay, has a very short range, and will not penetrate skin. <!-- NEEDS CITE Uranium compounds in general are poorly absorbed by the lining in the lungs and may remain a radiological hazard indefinitely. /NEEDS CITE --> [[Uranyl]] ({{chem|UO|2|2+}}) ions, such as from [[uranium trioxide]] or uranyl nitrate and other hexavalent uranium compounds, have been shown to cause birth defects and immune system damage in laboratory animals.<ref>{{cite journal |last1 = Domingo |first1 = JL |last2 = Paternain |first2 = JL |last3 = Llobet |first3 = JM |last4 = Corbella |first4 = J |title = The developmental toxicity of uranium in mice |journal = Toxicology |volume = 55 |issue = 1–2 |pages = 143–52 |year = 1989 |pmid = 2711400 |doi = 10.1016/0300-483X(89)90181-9}}</ref> While the CDC has published one study that no human [[cancer]] has been seen as a result of exposure to natural or depleted uranium,<ref name="ATSDR-PHS">{{cite web |url=http://www.atsdr.cdc.gov/phs/phs.asp?id=438&tid=77 |title=Public Health Statement for Uranium |publisher=CDC |accessdate=15 February 2007}}</ref> exposure to uranium and its decay products, especially [[radon]], are widely known and significant health threats.<ref name="BuildingBlocks480"/> Exposure to [[strontium-90]], [[iodine-131]], and other fission products is unrelated to uranium exposure, but may result from medical procedures or exposure to spent reactor fuel or fallout from nuclear weapons.<ref>Chart of the Nuclides, US Atomic Energy Commission 1968</ref> |
|||
Although accidental inhalation exposure to a high concentration of [[uranium hexafluoride]] has |
|||
resulted in human fatalities, those deaths were associated with generation of highly toxic hydrofluoric acid and [[uranyl fluoride]] rather than with uranium itself.<ref>{{cite book |url=http://books.google.com/?id=qDf3AO8nILoC&pg=PA1468 |page=1468 |title=Medical Toxicology |author=Dart, Richard C.|publisher=Lippincott Williams & Wilkins |year=2004 |isbn=0-7817-2845-2}}</ref> Finely divided uranium metal presents a fire hazard because uranium is [[pyrophoricity|pyrophoric]]; small grains will ignite spontaneously in air at room temperature.<ref name="LANL"/> |
|||
Uranium metal is commonly handled with gloves as a sufficient precaution.<ref name="DOH.WA">{{cite web|publisher=Washington State Department of Health, Office of Radiation Protection|url=http://www.doh.wa.gov/ehp/rp/factsheets/factsheets-htm/fs27uran.htm|title=Radiation Fact Sheets #27, Uranium (U) |year=2010|accessdate=23 August 2011}}</ref> Uranium concentrate is handled and contained so as to ensure that people do not inhale or ingest it.<ref name="DOH.WA"/> |
|||
{|class=wikitable |
|||
|- |
|||
|+ Recopilació de la ressenya de 2004 sobre la toxicitat de l'urani<ref name=Craft04/> |
|||
|- |
|||
!Sistema corporal |
|||
!Estudis en humans |
|||
!Estudis en animals |
|||
!''In vitro'' |
|||
|- |
|||
|Renal |
|||
|Elevated levels of protein excretion, urinary catalase and diuresis |
|||
|Damage to proximal convoluted tubules, necrotic cells cast from tubular epithelium, glomerular changes ([[renal failure]]) |
|||
|No studies |
|||
|- |
|||
|Brain/CNS |
|||
|Decreased performance on neurocognitive tests |
|||
|Acute cholinergic toxicity; Dose-dependent accumulation in cortex, midbrain, and vermis; Electrophysiological changes in hippocampus |
|||
|No studies |
|||
|- |
|||
|DNA |
|||
|Increased reports of cancers<ref name="ajph.org"/><ref>{{cite journal|doi=10.1289/ehp.01109305|pmc=1240251|title=Lung Cancer in a Nonsmoking Underground Uranium Miner |pmid=11333194|author=Mulloy KB, James DS, Mohs K, Kornfeld M|journal=Environ Health Perspect|year= 2001 |volume=109|issue=3|pages=305–309}}</ref><ref>{{cite journal|doi=10.1056/NEJM198406073102301 |title=Uranium mining and lung cancer in Navajo men|author=Samet JM, Kutvirt DM, Waxweiler RJ, Key CR |journal=N Engl J Med|year= 1984 |volume=310|issue=23|pages=1481–1584|pmc=6717538}}</ref><ref>{{cite journal|url=http://faculty.washington.edu/stevehar/Dawson.pdf|title=Navajo Uranium Workers and the Effects of Occupational Illnesses: A Case Study|author=Dawson, Susan E|year=1992|journal=Human Organization|volume =51|issue= 4 |pages=389–397}}</ref><ref>{{cite journal |title=Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993|author=Gilliland FD, Hunt WC, Pardilla M, Key CR|journal=J Occup Environ Med|year= 2000 |volume=42|issue=3|pages=278–283|pmid=10738707|doi=10.1097/00043764-200003000-00008}}</ref><ref>{{cite journal|author=Gottlieb LS, Husen LA.|doi=10.1378/chest.81.4.449 |title=Lung cancer among Navajo uranium miners |year=1982|journal=Chest|volume=81|issue=4|pages=449–52|pmid=6279361}}</ref> |
|||
|Increased mutagenicity (in mice) and induction of tumors |
|||
|Binucleated cells with micronuclei, Inhibition of cell cycle kinetics and proliferation; Sister chromatid induction, tumorigenic phenotype |
|||
|- |
|||
|Bone/muscle |
|||
|No studies |
|||
|Inhibition of periodontal bone formation; and alveolar wound healing |
|||
|No studies |
|||
|- |
|||
|Reproductive |
|||
|Uranium miners have more first born female children |
|||
|Moderate to severe focal tubular atrophy; vacuolization of Leydig cells |
|||
|No studies |
|||
|- |
|||
|Lungs/respiratory |
|||
|No adverse health effects reported |
|||
|Severe nasal congestion and hemorrhage, lung lesions and fibrosis, edema and swelling, lung cancer |
|||
|No studies |
|||
|- |
|||
|Gastrointestinal |
|||
|Vomiting, diarrhea, albuminuria |
|||
|No studies |
|||
|No studies |
|||
|- |
|||
|Liver |
|||
|No effects seen at exposure dose |
|||
|Fatty livers, focal necrosis |
|||
|No studies |
|||
|- |
|||
|Skin |
|||
|No exposure assessment data available |
|||
|Swollen vacuolated epidermal cells, damage to hair follicles and sebaceous glands |
|||
|No studies |
|||
|- |
|||
|Tissues surrounding embedded DU fragments |
|||
|Elevated uranium urine concentrations |
|||
|Elevated uranium urine concentrations, perturbations in biochemical and neuropsychological testing |
|||
|No studies |
|||
|- |
|||
|Immune system |
|||
|Chronic fatigue, rash, ear and eye infections, hair and weight loss, cough. May be due to combined chemical exposure rather than DU alone |
|||
|No studies |
|||
|No studies |
|||
|- |
|||
|Eyes |
|||
|No studies |
|||
|Conjunctivitis, irritation inflammation, edema, ulceration of conjunctival sacs |
|||
|No studies |
|||
|- |
|||
|Blood |
|||
|No studies |
|||
|Decrease in RBC count and hemoglobin concentration |
|||
|No studies |
|||
|- |
|||
|Cardiovascular |
|||
|Myocarditis resulting from the uranium ingestion, which ended 6 months after ingestion |
|||
|No effects |
|||
|No studies |
|||
|} |
|||
== Efectes nocius per a la salut == |
== Efectes nocius per a la salut == |
||
Revisió del 21:21, 20 nov 2013
| Urani | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
92U
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris metàl·lic platejat; en contacte amb l'aire, es corrou i forma una capa d'òxid negre espal·lat.  Línies espectrals de l'urani | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Urani, U, 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Actínids | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 238,02891(3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 5f3 6d1 7s2 2, 8, 18, 32, 21, 9, 2 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
19,1 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
17,3 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.405,3 K, 1.132,2 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 4.404 K, 4.131 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 9,14 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 417,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,665 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 3[1], 2, 1 (òxid bàsic feble) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,38 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 597,6 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.420 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 156 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 196±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Ortoròmbica 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (0 °C) 0,280 µΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 27,5 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 13,9 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.155 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops de l'urani | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'urani és un element químic metàl·lic de símbol U i nombre atòmic 92. És de color blanc platejat i pertany a la sèrie dels actínids de la taula periòdica. Un àtom d'urani té 92 protons i 92 electrons, dels quals 6 són electrons de valència. L'urani és feblement radioactiu perquè tots els seus isòtops són inestables. Els seus isòtops més comuns són l'urani-238 (que té 146 neutrons) i l'urani-235 (que té 143 neutrons). Té la segona massa atòmica més elevada dels elements primordials; només és més lleuger que el plutoni.[3] La densitat de l'urani és aproximadament un 70% major que la del plom, però no és tan dens com l'or o el tungstè. Ocorre de manera natural en concentracions baixes de poques parts per milió al sòl, en roca i en aigua, i s'extreu comercialment a partir de minerals que contenen urani, com la uraninita.
A la natura, l'urani es troba en forma d'urani-238 (99,2739–99,2752%), urani-235 (0,7198–0,7202%), i una quantitat molt petita d'urani-234 (0,0050–0,0059%).[4] L'urani es desintegra lentament i emet una partícula alfa. La semivida de l'urani-238 és d'uns 4.470 milions d'anys i la de l'urani-235 d'uns 704 milions d'anys,[5] la qual cosa fa que aquests isòtops siguin útils per datar l'edat de la Terra.
Molts usos contemporanis de l'urani exploten les propietats úniques del seu nucli. L'urani-235 té la particularitat de ser l'únic isòtop físsil que ocorre de manera natural. L'urani-238 és fissionable per neutrons ràpids, i és fèrtil, la qual cosa significa que pot ser transmutat a plutoni-239 físsil en un reactor nuclear. Un altre isòtop físsil, l'urani-233, pot ser produït a partir de tori natural i també és important en tecnologia nuclear. L'urani-238 té una baixa probabilitat d'entrar en fissió espontània o, fins i tot, en fissió induïda per neutrons ràpids, mentre que l'urani-235 i, en menor mesura, l'urani-233 tenen una secció eficaç de fissió molt més gran per neutrons lents. En una concentració suficient, aquests isòtops mantenen una reacció nuclear en cadena sostinguda que genera calor en rectors de centrals nuclears i produeix el material físsil per armes nuclears. L'urani empobrit (238U) s'utilitza en penetradors d'energia cinètica i blindatge de vehicles.[6]
L'urani s'utilitza com a colorant en vidre d'urani: produeix unes tonalitats que van del vermell-taronja al groc llimona. També s'utilitzava per tintar i ombrejar en els principis de la fotografia. La descoberta de l'urani en l'uraninita (1789) es reconeix a Martin Heinrich Klaproth, que anomenà el nou element en honor al planeta Urà. Eugène-Melchior Péligot fou la primera persona en aïllar el metall, i les seves propietats radioactives foren descobertes l'any 1896 per Henri Becquerel. La recerca duta a terme per Enrico Fermi i altres a partir del 1934 comportà la utilització de l'urani com a combustible de la indústria de l'energia nuclear així com de la Little Boy, la primera arma nuclear utilitzada en una guerra. La posterior cursa armamentista durant la Guerra Freda entre els Estats Units i la Unió Soviètica produí desenes de milers d'armes nuclears que utilitzaven l'urani metàl·lic i el plutoni-239, derivat de l'urani. La seguretat d'aquestes armes i del seu material físsil després del trencament de la URSS l'any 1991 encara és una preocupació per la seguretat i salut pública.[7]
Característiques
Quan es refina, l'urani és un metall de color blanc platejat, feblement radioactiu, que és més dur que la majoria d'elements. És mal·leable, dúctil, lleugerament paramagnètic, fortament electronegatiu i un pobre conductor elèctric.[8][9] L'urani metàl·lic té una elevada densitat: és aproximadament un 70% més dens que el plom, però lleugerament menys dens que l'or.

L'urani metàl·lic reacciona amb gairebé tots els elements no metàl·lics i els seus compostos; la seva reactivitat augmenta amb la temperatura.[10] Els àcids hidroclòric i nítric dissolen l'urani, però els àcids no oxidants diferents que l'hidroclòric ataquen l'element molt lentament.[8] L'urani dividit finament pot reaccionar amb aigua freda; en aire, l'urani metàl·lic es revesteix amb una capa fosca d'òxid d'urani.[9] L'urani de menes s'extreu químicament i es converteix en diòxid d'urani o altres formes químiques útils per la indústria.
L'urani-235 fou el primer isòtop que es descobrí que era físsil. Altres isòtops presents a la natura també són fissionables, però no físsils. Quan se'l bombardeja amb neutrons lents, l'isòtop urani-235 gairebé sempre es divideix en dos nuclis més petits i allibera energia d'enllaç nuclear i més neutrons. Si massa neutrons d'aquests són absorbits per un altre nucli d'urani-235 llavors té lloc una reacció nuclear en cadena que resulta en un alliberament de calor o bé (en circumstàncies especials) en una explosió. En un reactor nuclear, aquesta reacció en cadena ocorre lentament i és controlada mitjançant un verí de neutrons, el qual absorbeix alguns dels neutrons lliures. Aquests materials que absorbeixen neutrons solen formar part de les barres de control del reactor.
Es necessiten menys de 7 kg d'urani-235 per construir una bomba atòmica.[11] La primera bomba nuclear utilitzada en una guerra, la Little Boy, depenia de la fisió de l'urani, mentre que el primer explosiu nuclear, The gadget, i la bomba que destruí Nagasaki, Fat Man, eren bombes de plutoni.
L'urani metàl·lic té tres formes al·lòtropiques:[12]
- α (estructura ortoròmbica): estable fins a 660 °C
- β (estructura tetragonal): estable de 660 °C a 760 °C
- γ (estructura cúbica centrada en la cara): 760 °C fins al punt de fusió; aquest és l'estat de l'urani que el material és més mal·leable i dúctil.
Aplicacions
Àmbit militar
L'aplicació principal de l'urani en el sector militar és en els penetradors d'alta densitat. Aquesta munició consisteix en urani empobrit (UE) aliat amb un 1-2% d'altres elements. En un impacte a alta velocitat, la densitat, la duresa i la piroforicitat del projectil permeten la destrucció d'objectius blindats. Els tancs i altres vehicles blindats també es protegeixen amb cobertes d'urani empobrit. L'ús de l'urani empobrit esdevingué polèmic políticament i ambiental després que la seva utilització en municions dels Estats Units, del Regne Unit i d'altres països durant les guerres del Pèrsic i dels Balcans plantegés qüestions sobre els compostos d'urani abandonats al sòl (vegeu Síndrome de la guerra del Golf).[11]

L'urani empobrit també és utilitzat com a material de protecció en alguns contenidors utilitzats per emmagatzemar i transportar materials radioactius. Encara que el propi urani és radioactiu, la seva alta densitat el converteix en un material més efectiu que el plom per aturar la radiació de fonts intenses com el radi.[8] Altres usos de l'urani empobrit són com a contrapès de superfícies de control d'aeronaus, com a llast per a vehicles de reentrada i com a material protector.[9] A causa de la seva elevada densitat, aquest material es troba en sistemes de navegació inercials i en compassos giroscòpics.[9] Se sol preferir l'urani empobrit en comptes de metalls de densitat similar per la seva facilitat de mecanització i fosa , així com pel seu baix cost.[13] El risc principal de l'exposició a l'urani empobrit és l'enverinament químic d'òxid d'urani i no pas la radioactivitat (l'urani és tan sols un emissor alfa feble).
Durant les darreries de la Segona Guerra Mundial, la Guerra Freda i, encara que en menys mesura, durant les dècades posteriors, l'urani-235 fou utilitzat com el material físsil explosiu per produir armes nuclears. Inicialment es construïren dos tipus principals de bombes de fissió: un mecanisme relativament simple que utilitza l'urani-235 i un de més complicat que utilitza el plutoni-239, derivat de l'urani-238. Més tard es construí una bomba de fissió/fusió molt més complicada i, de llarg, molt més potent (una arma termonuclear); aquesta arma utilitza un mecanisme basat en el plutoni que causa una barreja de triti i deuteri per aconseguir la fusió nuclear. Aquest tipus de bombes estan encapsulades en una caixa no físsil (no enriquida) d'urani, i obtenen més de la meitat de la seva potència a partir de la fissió d'aquest material per neutrons ràpids a partir del procés de fusió nuclear.[14]
Àmbit civil
L'ús principal de l'urani en el sector civil és com a combustible de les centrals nuclears. Un quilogram d'urani-235 teòricament pot produir uns 80 terajoules d'energia (8×1013 joules) si s'assumeix una fissió completa; això equival a l'energia produïda per 3000 tones de carbó.[6]
Les centrals d'energia nuclear comercials utilitzen combustible que sol estar enriquit fins a aproximadament un 3% d'urani-235.[6] Els dissenys CANDU i Magnox són els únics reactors comercials capaços d'utilitzar combustible d'urani enriquit. El combustible utilitzat pels reactors de la marina dels Estats Units sol estar molt enriquit en urani-235 (els valors exactes són informació classificada). En un reactor ràpid també es pot convertir l'urani-238 en plutoni mitjançant la següent reacció:[9] 238U (n, gamma) → 239U -(beta) → 239Np -(beta) → 239Pu.

Abans del descobriment de la radioactivitat, l'urani s'utilitzava principalment en petites quantitats per fer vidres grocs i vidres ceràmics, tals com vidre d'urani.
La descoberta i aïllament del radi en la mena d'urani (pechblenda) per part de Marie Curie comportà el desenvolupament de la mineria d'extracció del radi, el qual s'utilitzava per fer pintures que brillaven en la foscor.[15] Aquest fet provocà que s'obtinguessin grans quantitats d'urani com a residus desaprofitats, ja que calen tres tones d'urani per extreure un gram de radi. Aquest producte residual fou derivat a la indústria de la vidrieria, la qual cosa convertí els productes d'urani en molt abundants i barats.

L'urani també fou utilitzat en substàncies químiques per la fotografia (especialment el nitrat d'urani com a tòner),[9] en filaments de làmpades, per millorar l'aparença de pròtesis dentals i en les indústries del cuir i de la fusta per fer tincions i tintats. Les sals d'urani són mordents de la seda i del cotó. L'acetat d'uranil i el format d'uranil s'utilitzen com a "taques" de gran densitat d'electrons per la microscòpia electrònica de transmissió, per augmentar el contrast d'espècimens biològics en seccions ultraprimes i en la tinció negativa de virus, orgànuls cel·lulars aïllats i macromolècules.
La descoberta de la radioactivitat de l'urani anà acompanyada de l'estudi de possibles usos científics i pràctics de l'element. La llarga semivida de l'isòtop urani-238 (4,51×109 anys) el col·loca en una bona posició per ser utilitzat per estimar l'edat de les primeres roques ígnies i per altres tipus de datació radiomètrica, entre els quals la datació per urani-tori, la datació per urani-plom i la datació per urani-urani. L'urani metàl·lic s'utilitza per objectius de raigs X en la creació de raigs X d'alta energia.[9]
Història
Fissió prehistòrica d'ocurrència natural
El 1972, el físic francès Francis Perrin descobrí quinze reactors de fissió nuclear naturals antics i ja inactius en tres dipòsits de menes separats a la mina d'Oklo, al Gabon, a l'oest de l'Àfrica, que es coneixen col·lectivament com a «Reactors fòssils d'Oklo». El dipòsit de menes té una antiguitat d'1,7 milions d'anys; en aquella època, l'urani-235 constituïa aproximadament el 3% del total d'urani terrestre.[16] Aquest percentatge és prou elevat per permetre l'ocurrència d'una reacció nuclear de fissió en cadena sostinguda, sempre i quan existeixin altres condicions necessàries. La capacitat dels sediments de l'entorn per contenir els productes nuclears residuals ha estat citada pel govern federal dels Estats Units com una evidència que dóna suport a la tesi sobre la viabilitat d'emmagatzemar combustible nuclear usat a Yucca Mountain.[16]
Ús anterior a la descoberta
L'ús de l'urani en la seva forma natural d'òxid data com a mínim de l'any 79 aC, quan s'utilitzava per donar un color groguenc a vidres ceràmics.[9] L'any 1912, R. T. Gunther, de la Universitat d'Oxford, trobà vidre groc amb un 1% d'urani en una vil·la romana del cap Posillipo, al golf de Nàpols (Itàlia).[17] A partir de l'edat mitjana tardana s'extragué pechblenda de les mines de plata dels Habsburg situades a Joachimsthal, Bohèmia (actual Jáchymov, República Txeca), la qual era utilitzada com un agent colorant en la indústria local de producció de vidre.[18] Als inicis del segle XIX, aquestes mines eren les úniques fonts de menes d'urani conegudes del món.
Descoberta

La descoberta de l'urani es reconeix al químic alemany Martin Heinrich Klaproth. Mentre estava treballant al seu laboratori experimental de Berlín l'any 1789, Klaproth fou capaç de precipitar un compost groguenc (probablement diuranat de sodi) dissolent pechblenda en àcid nítric i neutralitzant la solució amb hidròxid de sodi.[18] Klaproth assumí que la substància groguenca era l'òxid d'un element no descobert, i l'escalfà amb carbó vegetal per obtenir una pólvora negra, la qual cregué que ja era el nou metall que pretenia descobrir (de fet, la pólvora era un òxid d'urani).[18][19] Anomenà l'element acabat de descobrir en honor al planeta Urà (anomenat a la seva vegada en honor al déu grec Urà), descobert vuit anys enrere per l'astrònom William Herschel.[20]
El 1841, Eugène-Melchior Péligot, professor de Química analítica del Conservatoire National des Arts et Métiers (Conservatori Nacional d'Arts i Oficis) de París, aïllà la primera mostra d'urani metàl·lic escalfant tetraclorur d'urani amb potassi.[18][21] Durant la major part del segle XIX, l'urani no fou pas vist com una substància especialment perillosa, la qual cosa menà al desenvolupament de diversos usos per l'element.
Henri Becquerel descobrí la radioactivitat mitjançant urani el 1896.[10] Becquerel féu la descoberta a París deixant una mostra d'una sal d'urani, K2UO2(SO4)2 (sulfat uranil de potassi), a sobre d'una placa fotogràfica sense exposar, i notà que la placa es tornà borrosa.[22] Becquerel determinà llavors que una forma de llum invisible o raigs emesos per l'urani havien causat l'exposició de la placa.
Recerca de la fissió

El 1934, un equip liderat per Enrico Fermi observà que el bombardeig d'urani amb neutrons produeix una emissió de raigs beta (electrons o positrons dels elements produïts; vegeu Partícula beta)..[23] Al principi, els productes de fissió es confongueren amb nous elements de nombres atòmics 93 i 94, els quals el rector de la Facultat de Roma, Orso Mario Corbino, batejà com ausoni i hesperi, respectivament.[24][25][26][27] Els experiments que conduïren a la descoberta de la capacitat de l'urani per dividir-se en elements més lleugers (fissió) i alliberar energia d'enllaç foren duts a terme per Otto Hahn i Fritz Strassmann[23] al laboratori de Hahn, situat a Berlín. Lise Meitner i el seu nebot, el físic Otto Robert Frisch, publicaren l'explicació física el febrer de 1939 i anomenaren el procés com a «fissió nuclear».[28] Poc després, Fermi féu la hipòtesi que la fissió de l'urani podria alliberar prou neutrons per mantenir una reacció de fissió. La confirmació d'aquesta hipòtesi arribà l'any 1939, i treballs posteriors descobriren que s'alliberen una mitjana de 2,5 neutrons per cada fissió de l'isòtop rar urani-235.[23] Més tard, investigacions trobaren que l'isòtop molt més comú urani-238 pot ser transmutat en plutoni que, igual que l'urani-235, també és fissionable per neutrons tèrmics. Aquestes descobertes feren que molts països comencessin a treballar en el desenvolupament d'armes nuclears i de l'energia nuclear.
El 2 de desembre de 1942, com a part del Projecte Manhattan, un altre equip liderat per Enrico Fermi fou capaç d'iniciar la primera reacció nuclear en cadena artificial automantinguda (Chicago Pile-1). Treballant en un laboratori sota les graderies de l'Stagg Field de la Universitat de Chicago, l'equip creà les condicions necessàries per dur a terme tal reacció apilant 360 tones de grafit, 52 tones d'òxid d'urani i 5,5 tones d'urani metàl·lic, la majoria del qual fou aportat per la fàbrica de làmpades Westinghouse.[23][29]
Bombes

Els Estats Units desenvoluparen dos tipus principals de bombes atòmiques durant la Segona Guerra Mundial: una basada en urani (de nom en clau Little Boy), el material físsil de la qual era urani altament enriquit, i una basada en plutoni (vegeu Trinity i Fat Man), el plutoni de la qual era derivat de l'urani-238. La Little Boy esdevingué la primera arma nuclear utilitzada en una guerra quan fou detonada sobre la ciutat japonesa de Hiroshima el 6 d'agost de 1945. L'explosió i l'ona calorífica, equivalents a 12.500 tones de TNT, destruïren prop de 50.000 edificis i mataren aproximadament 75.000 persones (vegeu Bombardejos atòmics de Hiroshima i Nagasaki).[22] Inicialment es cregué que l'urani era relativament rar, i que la proliferació nuclear es podria evitar simplement comprant tots els estocs coneguts d'urani, però durant la següent dècada se'n descobriren grans dipòsits en molts llocs arreu del món.[30]
Reactors

El reactor de grafit X-10 (X-10 Graphite Reactor) de l'Oak Ridge National Laboratory (ORNL) d'Oak Ridge (Tennessee, Estats Units), originalment conegut com a Clinton Pile i X-10 Pile, fou el segon reactor nuclear artificial del món (després de la Chicago Pile d'Enrico Fermi) i fou el primer reactor dissenyat i construït per ser operat de manera contínua. El 20 de desembre de 1951, el reactor experimental reproductor I (Experimental Breeder Reactor I) de l'Argonne National Laboratory, ubicat a l'Atomic Energy Commission's National Reactor Testing Station prop d'Arco (Idaho, Estats Units), esdevingué el primer reactor nuclear que creà energia.[31] Inicialment, el reactor encengué quatre bombetes de 150 watts, però les millores dutes a terme permeteren més endavant donar potència a tota la instal·lació; més tard, la població d'Arco es convertí en la primera del món que tota la seva electricitat provenia de l'energia nuclear, en aquest cas generada pel reactor BORAX-III.[32] La primera central nuclear comercial del món, la central nuclear d'Obninsk, a la Unió Soviètica, començà a generar energia amb el reactor AM-1 el 27 de juny de 1954. Altres centrals nuclears pioneres foren Calder Hall (Anglaterra), que començà a operar el 17 d'octubre de 1956,[33] i la Shippingport (Pennsilvània, EUA), que començà a operar el 26 de maig de 1958. L'energia nuclear s'utilitzà per primer cop per propulsar un submarí (l'USS Nautilus) l'any 1954.[23][32]
Contaminació i el llegat de la Guerra Freda

Les proves nuclears de la Unió Soviètica i dels Estats Units durant la dècada de 1950 i a principis de la dècada de 1960, juntament amb les de França durant els anys 1970 i 1980[13] deixaren una quantitat significativa de pluja radioactiva arreu del món.[34] També hi hagué pluja radioactiva i pol·lució causades per accidents nuclears.[35][36]
Els miners d'urani presenten una freqüència més elevada de càncer. S'ha documentat i relacionat amb la seva professió, per exemple, un risc superior de càncer de pulmó entre els miners d'urani navajos.[37] La Radiation Exposure Compensation Act, una llei estatunidenca del 1990, determinà que la compensació econòmica pels miners d'urani que se'ls diagnostiqués càncer o altres complicacions respiratòries seria de 100.000 dòlars.[38]
Durant la Guerra Freda entre la Unió Soviètica i els Estats Units s'amassaren grans quantitats de reserves d'urani i es crearen desenes de milers d'armes nuclears fent servir urani enriquit i plutoni obtingut a partir de l'urani. A partir del desmembrament de la Unió Soviètica l'any 1991, s'estima que unes 540 tones d'armes d'urani altament enriquides (suficients per crear 40.000 caps nuclears) s'han emmagatzemat en instal·lacions mal vigilades de la Federació Russa i en molts altres antics estats de la URSS.[11] La policia de l'Àsia, d'Europa i de l'Amèrica del Sud interceptà carregaments nuclears d'urani o de plutoni de contraban com a mínim en 16 ocasions durant el període 1993-2005, la majoria dels quals provenien de fonts exsoviètiques.[11] De 1993 a 2005, el Programa de protecció, control i responsabilitat de material (Material Protection, Control, and Accounting Program) dels Estats Units, dut a terme pel govern federal dels Estats Units, destinà aproximadament 550 milions de dòlars per intentar salvaguardar les reserves d'urani i de plutoni de Rússia.[11] El pressupost fou utilitzat per fer millores a les instal·lacions d'emmagatzematge i de recerca.[39]
Abundància natural
Biòtic i abiòtic

L'urani és un element que abunda a la naturalesa: es pot trobar en baixos nivells en totes les roques, sòl i aigua. L'urani és el 51è element pel que fa a abundància a l'escorça terrestre. També és l'element de nombre atòmic més elevat que es pot trobar de manera natural en quantitats significatives a la Terra; gairebé sempre es troba combinat amb altres elements.[9] Juntament amb totes els elements que tenen una massa atòmica superior a la del ferro, l'urani només es forma de manera natural en supernoves.[40] Es creu que la desintegració d'urani, tori i potassi-40 en el mantell terrestre és la font principal de calor[41][42] que manté líquid el nucli extern i causa la convecció mantèl·lica la qual, al seu torn, és la causa de la tectònica de plaques.
La concentració d'urani mitjana a l'escorça terrestre és (segons la referència) de 2 a 4 parts per milió[8][13] o aproximadament 40 vegades l'abundància de la plata.[10] Es calcula que l'interval d'escorça terrestre que va de la superfície a 25 km de profunditat conté 1017 kg d'urani, mentre que els oceans en poden contenir 1013 kg.[8] La concentració d'urani en el sòl va des de 0,7 a 11 parts per milió (i fins a 15 parts per milió en sòl agrícola a causa de l'ús de fertilitzants amb fosfat), i la seva concentració en aigua marina és de 3 parts per mil milions.[13]
L'urani és més abundant que l'antimoni, l'estany, el cadmi, el mercuri o la plata, i és més o menys tan abundant com l'arsènic o el molibdè.[9][13] Es troba en centenars de minerals entre els quals l'uraninita (la mena d'urani més comuna), la carnotita, l'autunita, l'uranofana, la torbernita i la coffinita.[9] Algunes substàncies contenen concentracions significatives d'urani, tals com els dipòsits de roques fosfòriques, així com minerals com la lignita i sorres de monazita en menes riques en urani[9] (s'obté comercialment a partir de fonts que tenen concentracions tan baixes com del 0,1% d'urani[10]).

S'ha demostrat que alguns bacteris com S. putrefaciens i G. metallireducens redueixen U(VI) a U(IV).[43] Alguns organismes com el liquen Trapelia involuta o microorganismes com els citrobacteris poden absorbir concentracions d'urani que són fins a 300 vegades superiors a les de l'ambient.[44] Els citrobacteris absorbeixen ions uranil quan se'ls dóna glicerol-3-fosfat (o altres fosfats orgànics similars). Un cop passat un dia, un gram de bacteris es pot incrustar amb nou grams de cristalls de fosfat d'uranil, la qual cosa crea la possibilitat que aquests organismes puguin ser usats en un futur en bioremediació per descontaminar aigua contaminada amb urani.[18][45] També s'ha descobert que el proteobacteri Geobacter bioremedia l'urani d'aigües subterrànies.[46]
A la naturalesa, l'urani (VI) forma complexos carbonats altament solubles en pH alcalins. Això n'augmenta la mobilitat i la presència al sòl i les aigües subterrànies provinent de residus nuclears, cosa que representa un perill per la salut. Tanmateix, resulta difícil precipitar urani en forma de fosfat en presència d'un excés de carbonat en pH alcalins. S'ha descobert que una soca de Sphingomonas sp. BSAR-1 expressa una fosfatasa alcalina (PhoK) de gran activitat, que ha estat utilitzada per bioprecipitar l'urani de solucions alcalines en forma d'espècies de fosfat d'uranil. Aquesta capacitat de precipitació s'ha potenciat mitjançant la sobreexpressió de PhoK en E. coli.[47]
Les plantes absorbeixen una mica d'urani del sòl. Les concentracions de pes en sec d'urani a les plantes es troben en el rang de 5 a 60 parts per mil milions, i la cendra de fusta cremada pot tenir concentracions de fins a 4 parts per milió.[18] Quantificada en pes en sec, la concentració d'urani a les plantes alimentàries és més baixa, en general. La gent n'ingereix un o dos micrograms al dia amb el menjar.[18]
Producció i explotació minera


La producció mundial d'urani el 2010 fou de 53.663 tones, de les quals 17.803 (el 33,2%) foren extretes de mines del Kazakhstan. Altres països importants pel que fa a la mineria de l'urani són el Canadà (9.783 t), Austràlia (5.900 t), Namíbia (4.496 t), Níger (4.198 t) i Rússia (3.562 t).[48]
La mena d'urani s'extreu de les mines de diverses maneres: a cel obert, en mines subterrànies, per lixiviació in situ i per mineria de perforació (vegeu Mineria de l'urani).[6] Un mineral d'urani pobre sol contenir entre un 0,01% i un 0,25% d'òxids d'urani.[49] Els minerals rics que es troben als dipòsits d'Athabasca Basin de la regió de Saskatchewan, al Canadà, poden contenir fins a un 23% d'òxids d'urani de mitjana.[50] La mena d'urani es tritura, es converteix en una fina pols i, a continuació, es lixivia amb un àcid o un àlcali. El lixiviat resultant se sotmet llavors a una seqüència de precipitació, extracció de solvent i intercanvi de ions. La barreja resultant, anomenada yellowcake (concentrat d'urani en pols obtingut a partir de solucions lixiviades de mineral d'urani), conté com a mínim un 75% d'òxids d'urani U3O8. En aquest punt, el yellowcake es calcina per eliminar les impureses abans de la refinació i la conversió.[51]
L'urani de qualitat comercial es pot produir mitjançant la reducció d'halurs d'urani amb àlcalis o UF
4, dissolt en una solució de clorur de calci fos (CaCl
2) i clorur de sodi (NaCl).[9] L'urani molt pur es produeix mitjançant la descomposició tèrmica d'halurs d'urani en un filament calent.[9]
Recursos i reserves
S'estima que existeixen 5,5 milions de tones d'urani en reserves de menes que són econòmicament viables a 59 dòlars per lliura d'urani,[52] mentre que 35 milions de tones estan classificades com a recursos minerals (prospectes raonables de cares a una futura extracció econòmica).[53] Els preus variaren de 10$/lliura el maig de 2003 fins a 138$/lliura el juliol de 2007, cosa que ha causat un gran increment en la despesa d'exploració:[52] el 2006 es destinaren mundialment 200 milions de dòlars a aquest concepte, la qual cosa representà un 54% d'increment respecte l'any anterior.[53] La tendència continuà l'any següent, en el qual la despesa en exploració es disparà fins als 774 milions de dòlars, un increment de més del 250% respecte el 2004.[52]
Austràlia posseeix el 31% de les reserves de menes d'urani mundials conegudes[54] així com el dipòsit més gran d'urani del món, ubicat a la mina d'Olympic Dam, a Austràlia Meridional.[55] Hi ha una important reserva d'urani a Bakouma, una subprefectura de la prefectura de Mbomou a la República Centreafricana.
Part del combustible nuclear prové de les armes nuclears que s'estan desmantellant[56] com, per exemple, del Megatons to Megawatts Program.
S'estima que unes 4.600 milions de tones d'urani addicionals es troben a l'aigua de mar; científics japonesos demostraren durant la dècada de 1980 que l'extracció d'urani de l'aigua marina utilitzant intercanviadors de ions és factible.[57][58] S'han dut a terme experiments per extraure urani de l'aigua de mar,[59] però el retorn fou baix a causa de la presència de carbonats en l'aigua. El 2012, investigadors de l'ORNL anunciaren el desenvolupament d'un nou material absorbent anomenat HiCap que és capaç d'eliminar amb èxit metalls tòxics de l'aigua.[60][61]
Subministrament

El 2005, disset països produïen òxids d'urani concentrats, dels quals el Canadà (27,9% de la producció mundial) i Austràlia (22,8%) n'eren els principals productors; el Kazakhstan (10,5%), Rússia (8,0%), Namíbia (7,5%), Níger (7,4%), l'Uzbekistan (5,5%), els Estats Units (2,5%), Argentina (2,1%), Ucraïna (1,9%) i la Xina (1,7%) també en produïren quantitats significatives.[63] L'urani disponible es creu que serà suficient com a mínim fins l'any 2090, encara que el desenvolupament de la tecnologia del reactor ràpid podria fer canviar la previsió a una disponibilitat fins d'aquí a 2.500 anys.[53] Alguns estudis indiquen, però, que la infrainversió de les darreries del segle XX pot causar problemes d'abastament durant el segle XXI.[64] Sembla que els dipòsits d'urani segueixen una distribució lognormal. La quantitat d'urani recuperable augmenta un 30.000% per cada reducció d'un 90% en la riquesa del mineral.[65] En altres paraules, hi ha disponible poc mineral ric i proporcionalment molt més mineral pobre.
Compostos
Òxids i estats d'oxidació
Òxids

|

| |
L'octaòxid de triurani (a l'esquerra) i el diòxid d'urani (a la dreta) són els dos òxids més comuns de l'urani.
| ||
El yellowcake calcinat conté una distribució d'espècies d'oxidació d'urani en diverses formes que van des de la menys oxidada a la més oxidada. Les partícules que tenen temps de residència baixos al calcinador són, en general, menys oxidades que les que tenen temps llargs de retenció o que les partícules recuperades al stack scrubber. El contingut de l'urani se sol denotar per U
3O
8, fórmula que data de l'època del Projecte Manhattan, quan el U
3O
8 era utilitzat com un estàndard en química analítica.
Les relacions de fase en el sistema urani-oxigen són complexes. Els estats d'oxidació més importants de l'urani són l'urani (IV) i l'urani (VI); els seus dos òxids corresponents són, respectivament, el diòxid d'urani (UO
2) i el triòxid d'urani (UO
3).[66] També existeixen altres òxids d'urani com el monòxid d'urani (UO), el pentòxid de diurani (U
2O
5) i el peròxid d'urani (UO
4·2H
2O).
Les formes més comunes de l'òxid d'urani són l'octaòxid de triurani (U
3O
8) i el UO
2.[67] Ambdues formes són sòlids de baixa solubilitat en aigua i relativament estables en un ventall ampli de condicions ambientals. L'octaòxid de triurani és (segons les condicions) el compost d'urani més estable i la forma que es troba més sovint a la naturalesa. El diòxid d'urani és la forma de l'urani que més s'utilitza com a combustible de reactors nuclears.[67] A temperatura ambient, el UO
2 es converteix de manera gradual a U
3O
8. A causa de la seva estabilitat, els òxids d'urani se solen considerar la forma química preferida per l'emmagatzematge i disponibilitat de l'element.[67]
Química aquosa

Les sals de molts estats d'oxidació de l'urani són solubles en aigua i poden ser estudiants en solucions aquoses. Les formes iòniques més comunes són U3+
(marró-vermella), U4+
(verda), UO+
2 (inestable) i UO2+
2 (groga), per el U(III), el U(IV), el U(V) i el U(VI), respectivament.[68] Existeixen alguns compostos sòlids i semimetàl·lics tals com el UO i el US per l'estat d'oxidació formal U(II), però no es coneixen ions simples que existeixin en solució per aquest estat. Els ions del U3+
alliberen hidrogen de l'aigua i, per tant, es consideren altament inestables. El ió UO2+
2 represente l'estat de l'urani (VI) i se sap que forma compostos com el carbonat d'uranil, el clorur d'uranil i el sulfat d'uranil. El UO2+
2 també forma complexos amb diversos agents orgànics quelats, dels quals el que es troba d'una manera més comuna és l'acetat d'uranil.[68]
A diferència de les sals d'uranil de l'urani i de les formes de ió poliatòmic catiòniques urani-òxid, els uranats –les sals que contenen un anió poliatòmic urani-òxid– generalment no són solubles en aigua.
Carbonats
Les interaccions d'anions carbonat amb urani (VI) causen que el diagrama de Pourbaix canviï molt quan el medi canvia d'aigua a una solució amb contingut de carbonat. Mentre que la gran majoria de carbonats són insolubles en aigua, els carbonats d'urani solen ser-hi solubles: això passa perquè un catió de U(VI) és capaç d'enllaçar dos terminals òxid i tres o més carbonats per formar complexos aniònics.
 |
 |
| Urani en un medi aquós no complex (per exemple, àcid perclòric/hidròxid de sodi)[69] | Urani en una solució carbonatada |
 |
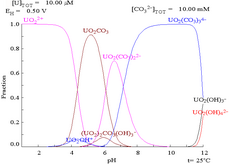 |
| Concentracions relatives de les diferents formes químiques de l'urani en un medi aquós no complex (per exemple, àcid perclòric/hidròxid de sodi)[69] | Concentracions relatives de les diferents formes químiques de l'urani en una solució aquosa carbonatada[69] |
Efectes del pH
Els diagrames de fracció d'urani en presència de carbonats il·lustren el següent: quan el pH de la solució d'urani (VI) augmenta, l'urani es converteix en un hidròxid d'òxid d'urani hidratat i, en pH elevats, esdevé un hidròxid aniònic complex.
Quan s'hi afegeix un carbonat, l'urani es converteix en una sèrie de carbonats complexos si s'incrementa el pH. Un efecte d'aquestes reaccions és l'augment de la solubilitat de l'urani en el rang de pH de 6 a 8, un fet que té una influència directa en l'estabilitat a llarg termini dels combustibles nuclears de diòxid d'urani consumits.
Hidrurs, carburs i nitrurs
El metall d'urani escalfat fins a 250-300 ºC reacciona amb l'hidrogen per formar hidrur d'urani; l'assoliment de temperatures més elevades fa que s'elimini l'hidrogen de manera reversible. Aquesta propietat converteix els hidrurs d'urani en materials inicials convenients per crear pols d'urani reactiu juntament amb diversos compostos de carburs, nitrurs i halurs d'urani.[70] Existeixen dues modificacions cristal·lines de l'hidrur d'urani: la forma α, que s'obté a baixes temperatures, i la forma β, que es crea quan la temperatura de formació és superior als 250 ºC.[70]
Els carburs d'urani i els nitrurs d'urani són tots dos compostos semimetàl·lics relativament interts que són mínimament solubles en àcids, reaccionen amb l'aigua i es poden encendre en aire per formar U
3O
8.[70] Els carburs d'urani inclouen el monocarbur d'urani (UC), el dicarbur d'urani (UC
2) i el tricarbur de diurani (U
2C
3). Tant el UC com el UC
2 són formats mitjançant l'addició de carboni a l'urani fos o bé exposant el metall a monòxid de carboni a altes temperatures. El U
2C
3, d'altra banda, és estable per sota dels 1.800 ºC i es prepara sotmetent una barreja de UC i de UC
2 a tensions mecàniques.[71] Els nitrurs d'urani obtinguts mitjançant exposició directa del metall al nitrogen inclouen el mononitrur d'urani (UN), el dinitrur d'urani (UN
2) i el trinitrur de duirani (U
2N
3).[71]
Halurs

Tots els fluorurs d'urani són creats utilitzant el tetrafluorur d'urani (UF
4); el propi UF
4 es prepara mitjançant la hidrofluorinació del diòxid d'urani.[70] La reducció del UF
4 amb hidrogen a 1000 ºC produeix trifluorur d'urani (UF
3). Sota les condicions adients de temperatura i pressió, la reacció de UF
4 sòlid amb hexafluorur d'urani gasós (UF
6) pot formar els fluorurs intermediaris U
2F
9, U
4F
17 i UF
5.[70]
A temperatura ambient, el UF
6 té una elevada pressió de vapor, la qual cosa fa que sigui útil en el procés de difusió gasosa per separar el rar urani-235 de l'isòtop més comú urani-238. Aquest compost es pot preparar a partir de diòxid d'urani i d'hidrur d'urani mitjançant el procés descrit a continuació:[70]
- UO
2 + 4 HF → UF
4 + 2 H
2O (500 °C, endotèrmic) - UF
4 + F
2 → UF
6 (350 °C, endotèrmic)
El UF
6 resultant, un sòlid blanc, és altament reactiu (per fluorinació), sublima fàcilment (emetent un vapor que es comporta gairebé com un gas ideal) i és el compost més volàtil d'urani que es coneix.[70]
Un mètode de preparació del tetraclorur d'urani (UCl
4) consisteix en combinar directament clor amb urani metàl·lic o bé amb hidrur d'urani. La reducció del UCl
4 amb hidrogen produeix triclorur d'urani (UCl
3) mentre que els clorurs d'urani més alts es preparen fent reaccionar més clor.[70] Tots els clorurs d'urani reaccionen amb l'aigua i l'aire.
Els bromurs i iodurs d'urani es formen mitjançant la reacció directa de brom i iode amb urani, respectivament, o bé afegint UH
3 als àcids d'aquests elements.[70] Alguns exemples coneguts són el UBr
3, el UBr
4, el UI
3 i el UI
4. Els oxohalurs d'urani són solubles en aigua i inclouen els següents compostos: UO
2F
2, UOCl
2, UO
2Cl
2 i UO
2Br
2. L'estabilitat dels oxohalurs decreix amb l'augment del pes atòmic del component halur.[70]
Isòtops ===== Concentracions naturals =
L'urani natural està format per tres isòtops principals: l'urani-238 (amb una abundància natural del 99,28%), l'urani-235 (0,71%) i l'urani-234 (0,0054%). Tots tres isòtops són radioactius –emeten partícules alfa–, i també tots tres tenen poques probabilitats de patir fissió espontània en comptes d'emissió alfa.
L'urani-238 és l'isòtop més estable de l'urani: té una semivida d'uns 4,468×109 anys, la qual equival aproximadament a l'edat de la Terra. L'urani-235 té una semivida d'uns 7,13×108 anys, i l'urani-234 de 2,48×105 anys.[72] Pel que respecta a l'urani natural, tan sols al voltant d'un 49% dels seus raigs alfa són emesos per cada àtom de 238U; també al voltant d'un 49% pel 234U (ja que aquest darrer es forma a partir del primer); i aproximadament un 2% són emesos pel 235U. Quan la Terra era jove, probablement un cinquè del seu urani era urani-235 i el percentatge d'urani-234 era molt més baix que aquest.
Normalment l'urani-238 és un emissor α (ocasionalment pateix fissió espontània) i es desintegra mitjançant la "sèrie de l'urani" de desintegració nuclear, la qual té 18 membres que, al final, es desintegren en plom-206 per mitjà de diferents camins de desintegració.[10] A més, l'urani-238 no és físsil, però és un isòtop fèrtil, perquè després de l'activació neutrònica pot produir plutoni-239, un altre isòtop físsil. De fet, el nucli del 238U pot absorbir un neutró per a produir un isòtop radioactiu urani-239. El 239U es desintegra mitjançant emissió beta en neptuni-239, també un emissor beta, que al seu torn es desintegra en pocs dies en plutoni-239. El 239Pu s'utilitzà com a material físsil en la primera bomba atòmica detonada durant l'assaig nuclear Trinity el 15 de juliol de 1945 a Nou Mèxic, als Estats Units.[23]
La cadena de desintegració del 235U té 15 membres dels quals tots acaben per desintegrar-se en plom-207.[10] Les taxes constants de desintegració d'aquesta cadena fa que la comparació de proporcions d'elements pare i fill sigui útil per la datació radiomètrica. A més a més, l'urani-235 és important tant pels reactors nuclears com per les armes nuclears, ja que es tracta de l'únic isòtop d'urani que existeix a la naturalesa en una quantitat significativa que és físsil, la qual cosa significa que pot ser dividit en dos o tres fragments (productes de fissió) mitjançant neutrons tèrmics.[10]
L'urani-234 és membre de la "sèrie de l'urani", i es desintegra en plom-206 mitjançant una sèrie d'isòtops de semivida relativament curta. D'altra banda, l'urani-233 s'obté a partir del tori-232 amb bombardeig de neutrons –normalment en un reactor nuclear– i, a més, sol ser físsil.[9] La seva cadena de desintegració acaba amb el tal·li-205.
Enriquiment

A la naturalesa, l'urani es troba en forma d'urani-238 (99,2742%) i d'urani-235 (0,7204%). La separació isotòpica concentra (enriqueix) l'urani-235 fissionable per armes nuclears i la majoria de centrals nuclears, excepte per reactors de gas i reactors d'aigua pesada pressuritzada. La majoria dels neutrons alliberats per un àtom d'urani-235 que fissiona han d'impactar altres àtoms d'urani-235 per tal de sostenir la reacció nuclear en cadena. La concentració i quantitat d'urani-235 necessàries per aconseguir-ho s'anomenen massa crítica.
Per ser considerat com a "enriquit", la fracció d'urani-235 ha d'estar entre el 3% i el 5%.[73] Aquest procés produeix grans quantitats d'urani empobrit d'urani-235 i enriquit (és a dir, amb una fracció incrementada) d'urani-238 anomenat urani empobrit. Per ser considerat com a "empobrit", la concentració isotòpica d'urani-235 no ha de ser superior al 0,3%.[74] The price of uranium has risen since 2001, so enrichment tailings containing more than 0.35% uranium-235 are being considered for re-enrichment, driving the price of depleted uranium hexafluoride above $130 per kilogram in July 2007 from $5 in 2001.[74]
El procés de centrifugació de gas, en el qual se separa l'hexafluorur d'urani (UF
6) gràcies a la diferència de pes molecular entre el 235UF6 i el 238UF6 mitjançant centrifugadores d'alta velocitat, és el procés d'enriquiment més barat i més utilitzat.[22] D'altra banda, el procés de difusió gasosa havia estat anteriorment el mètode principal d'enriquiment; de fet, fou utilitzat en el Projecte Manhattan. En aquest procés, l'hexafluorur d'urani és difós repetidament a través d'una membrana de plata-zinc, i els diferents isòtops de l'urani són separats gràcies a la taxa de difusió (com que l'urani-238 és més pesat, la seva difusió és una mica més lenta que la de l'urani-235).[22] El mètode de separació isotòpica mitjançant làser molecular fa servir un raig làser d'energia precisa per trencar l'enllaç entre l'urani-235 i el fluor, la qual cosa deixa l'urani-238 enllaçat amb el fluor i permet la precipitació del metall urani-235.[6] Un mètode alternatiu d'enriquiment amb làser es coneix com separació isotòpica mitjançant làser de vapor atòmic, i fa servir làsers regulables tals com els làsers de colorant.[75] Un altre mètode utilitzat és la difusió tèrmica líquida.[8]
Exposició humana
|
|
A person can be exposed to uranium (or its radioactive daughters such as radon) by inhaling dust in air or by ingesting contaminated water and food. The amount of uranium in air is usually very small; however, people who work in factories that process phosphate fertilizers, live near government facilities that made or tested nuclear weapons, live or work near a modern battlefield where depleted uranium weapons have been used, or live or work near a coal-fired power plant, facilities that mine or process uranium ore, or enrich uranium for reactor fuel, may have increased exposure to uranium.[76][77] Houses or structures that are over uranium deposits (either natural or man-made slag deposits) may have an increased incidence of exposure to radon gas.
Most ingested uranium is excreted during digestion. Only 0.5% is absorbed when insoluble forms of uranium, such as its oxide, are ingested, whereas absorption of the more soluble uranyl ion can be up to 5%.[18] However, soluble uranium compounds tend to quickly pass through the body whereas insoluble uranium compounds, especially when inhaled by way of dust into the lungs, pose a more serious exposure hazard. After entering the bloodstream, the absorbed uranium tends to bioaccumulate and stay for many years in bone tissue because of uranium's affinity for phosphates.[18] Uranium is not absorbed through the skin, and alpha particles released by uranium cannot penetrate the skin.
Incorporated uranium becomes uranyl ions, which accumulate in bone, liver, kidney, and reproductive tissues. Uranium can be decontaminated from steel surfaces[78] and aquifers.[79]
Efectes i precaucions
Normal functioning of the kidney, brain, liver, heart, and other systems can be affected by uranium exposure, because, besides being weakly radioactive, uranium is a toxic metal.[18][80][81] Uranium is also a reproductive toxicant.[82][83] Radiological effects are generally local because alpha radiation, the primary form of 238U decay, has a very short range, and will not penetrate skin. Uranyl (UO2+
2) ions, such as from uranium trioxide or uranyl nitrate and other hexavalent uranium compounds, have been shown to cause birth defects and immune system damage in laboratory animals.[84] While the CDC has published one study that no human cancer has been seen as a result of exposure to natural or depleted uranium,[85] exposure to uranium and its decay products, especially radon, are widely known and significant health threats.[13] Exposure to strontium-90, iodine-131, and other fission products is unrelated to uranium exposure, but may result from medical procedures or exposure to spent reactor fuel or fallout from nuclear weapons.[86]
Although accidental inhalation exposure to a high concentration of uranium hexafluoride has
resulted in human fatalities, those deaths were associated with generation of highly toxic hydrofluoric acid and uranyl fluoride rather than with uranium itself.[87] Finely divided uranium metal presents a fire hazard because uranium is pyrophoric; small grains will ignite spontaneously in air at room temperature.[9]
Uranium metal is commonly handled with gloves as a sufficient precaution.[88] Uranium concentrate is handled and contained so as to ensure that people do not inhale or ingest it.[88]
| Sistema corporal | Estudis en humans | Estudis en animals | In vitro |
|---|---|---|---|
| Renal | Elevated levels of protein excretion, urinary catalase and diuresis | Damage to proximal convoluted tubules, necrotic cells cast from tubular epithelium, glomerular changes (renal failure) | No studies |
| Brain/CNS | Decreased performance on neurocognitive tests | Acute cholinergic toxicity; Dose-dependent accumulation in cortex, midbrain, and vermis; Electrophysiological changes in hippocampus | No studies |
| DNA | Increased reports of cancers[38][89][90][91][92][93] | Increased mutagenicity (in mice) and induction of tumors | Binucleated cells with micronuclei, Inhibition of cell cycle kinetics and proliferation; Sister chromatid induction, tumorigenic phenotype |
| Bone/muscle | No studies | Inhibition of periodontal bone formation; and alveolar wound healing | No studies |
| Reproductive | Uranium miners have more first born female children | Moderate to severe focal tubular atrophy; vacuolization of Leydig cells | No studies |
| Lungs/respiratory | No adverse health effects reported | Severe nasal congestion and hemorrhage, lung lesions and fibrosis, edema and swelling, lung cancer | No studies |
| Gastrointestinal | Vomiting, diarrhea, albuminuria | No studies | No studies |
| Liver | No effects seen at exposure dose | Fatty livers, focal necrosis | No studies |
| Skin | No exposure assessment data available | Swollen vacuolated epidermal cells, damage to hair follicles and sebaceous glands | No studies |
| Tissues surrounding embedded DU fragments | Elevated uranium urine concentrations | Elevated uranium urine concentrations, perturbations in biochemical and neuropsychological testing | No studies |
| Immune system | Chronic fatigue, rash, ear and eye infections, hair and weight loss, cough. May be due to combined chemical exposure rather than DU alone | No studies | No studies |
| Eyes | No studies | Conjunctivitis, irritation inflammation, edema, ulceration of conjunctival sacs | No studies |
| Blood | No studies | Decrease in RBC count and hemoglobin concentration | No studies |
| Cardiovascular | Myocarditis resulting from the uranium ingestion, which ended 6 months after ingestion | No effects | No studies |
Efectes nocius per a la salut

L'urani en qualsevol de les seves formes (natural, enriquit o empobrit), en ésser un metall pesant, posseeix una certa toxicitat, podent afectar el sistema renal, depenent els efectes de la quantitat incorporada a l'organisme.
A més l'urani, per la inestabilitat del seu nucli, presenta radiotoxicitat. És el pare d'una de les cadenes naturals, sent un dels seus fills radioactius el radó-222, considerat cancerigen i amb sinergies amb el fum del tabac. L'exposició directa a la radioactivitat de l'urani, en nivells prou importants, pot causar la síndrome de les radiacions aguda.
Pel que fa al medi ambient, l'activitat dels humans amb urani és font de contaminació radioactiva, que compren les fases de mineria, purificació, processat i dipòsit dels residus.
Vegeu també
Referències
- ↑ Morss, L.R.; Edelstein, N.M. and Fuger, J.. The Chemistry of the Actinide and Transactinide Elements (en anglès). 3a ed. Països Baixos: Springer, 2006. ISBN 9048131464.
- ↑ Magurno, B.A.; Pearlstein, S. Proceedings of the conference on nuclear data evaluation methods and procedures. BNL-NCS 51363, vol. II (en anglès). Brookhaven National Lab., 1981, p. 835 ff.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. «Detection of Plutonium-244 in Nature». Nature, vol. 234, 5325, 1971, pàg. 132–134. Bibcode: 1971Natur.234..132H. DOI: 10.1038/234132a0.
- ↑ «Uranium Isotopes».
- ↑ «WWW Table of Radioactive Isotopes». Lawrence Berkeley National Laboratory, Berkeley, Estats Units.
- ↑ 6,0 6,1 6,2 6,3 6,4 Emsley 2001, p. 479.
- ↑ «U.S. to pump money into nuke stockpile, increase security». RIA Novosti, 18-02-2010.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 «Uranium». A: The McGraw-Hill Science and Technology Encyclopedia. 5a edició. The McGraw-Hill Companies, Inc.. ISBN 0-07-142957-3.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 9,12 9,13 9,14 9,15 Hammond, C. R.. The Elements, in Handbook of Chemistry and Physics. 81a edició. CRC press, 2000. ISBN 0-8493-0481-4.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 «uranium». A: Columbia Electronic Encyclopedia. 6a edició. Columbia University Press.
- ↑ 11,0 11,1 11,2 11,3 11,4 «Uranium». A: Encyclopedia of Espionage, Intelligence, and Security. The Gale Group, Inc..
- ↑ Rollett, A. D.. Applications of Texture Analysis. John Wiley and Sons, 2008, p. 108. ISBN 0-470-40835-9.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 Emsley 2001, p. 480
- ↑ «Nuclear Weapon Design». Federation of American Scientists, 1998.
- ↑ «Dial R for radioactive». New Scientist, 12-07-1997.
- ↑ 16,0 16,1 «Oklo: Natural Nuclear Reactors». Office of Civilian Radioactive Waste Management. Arxivat de l'original el 3 juny 2004.
- ↑ Emsley 2001, p. 482
- ↑ 18,00 18,01 18,02 18,03 18,04 18,05 18,06 18,07 18,08 18,09 Emsley 2001, p. 477
- ↑ Klaproth, M. H. «Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz». Chemische Annalen, vol. 2, 1789, pàg. 387–403.
- ↑ «Uranium». A: The American Heritage Dictionary of the English Language. 4a edició. Houghton Mifflin Company.
- ↑ Péligot, E.-M. «Recherches Sur L'Uranium». Annales de chimie et de physique, vol. 5, 5, 1842, pàg. 5–47.
- ↑ 22,0 22,1 22,2 22,3 Emsley 2001, p. 478
- ↑ 23,0 23,1 23,2 23,3 23,4 23,5 Seaborg 1968, p. 773
- ↑ Fermi, Enrico. «Artificial radioactivity produced by neutron bombardment: Nobel Lecture» (PDF). Royal Swedish Academy of Sciences, 12 December 1938.
- ↑ De Gregorio, A. «A Historical Note About How the Property was Discovered that Hydrogenated Substances Increase the Radioactivity Induced by Neutrons». Nuovo Saggiatore, vol. 19, 2003, pàg. 41–47. arXiv: physics/0309046. Bibcode: 2003physics...9046D.
- ↑ Nigro, M. «Hahn, Meitner e la teoria della fissione», 2004.
- ↑ van der Krogt, Peter. «Elementymology & Elements Multidict».
- ↑ «Disintegration of Uranium by Neutrons: a New Type of Nuclear Reaction». Nature, vol. 143, 5218, 1939, pàg. 239–240. Bibcode: 1969Natur.224..466M. DOI: 10.1038/224466a0.
- ↑ Walsh, John «A Manhattan Project Postscript». Science. AAAS, vol. 212, 19-06-1981, pàg. 1369–1371. Bibcode: 1981Sci...212.1369W. DOI: 10.1126/science.212.4501.1369. ISSN: 0036-8075 [Consulta: 23 març 2013].
- ↑ Helmreich, J.E.. «10». A: Princeton University Press. Gathering Rare Ores: The Diplomacy of Uranium Acquisition, 1943–1954, 1986:. ISBN 0-7837-9349-9.
- ↑ «Reactors Designed by Argonne National Laboratory: Fast Reactor Technology». U.S. Department of Energy, Argonne National Laboratory, 2012.
- ↑ 32,0 32,1 «Reactors Designed by Argonne National Laboratory: Light Water Reactor Technology Development». Departament d'Energia dels Estats Units, Argonne National Laboratory, 2012.
- ↑ «1956:Queen switches on nuclear power». BBC news, 17-10-1956.
- ↑ Warneke, T.; Croudace, I. W.; Warwick, P. E. i Taylor, R. N. «A new ground-level fallout record of uranium and plutonium isotopes for northern temperate latitudes». Earth and Planetary Science Letters, vol. 203, 3–4, 2002, pàg. 1047–1057. Bibcode: 2002E&PSL.203.1047W. DOI: 10.1016/S0012-821X(02)00930-5.
- ↑ Newtan, Samuel Upton. AuthorHouse. Nuclear War I and Other Major Nuclear Disasters of the 20th Century, 2007. ISBN 1425985122.
- ↑ «The Worst Nuclear Disasters». Time.com, 25-03-2009.
- ↑ Gilliland, Frank D. MD; Hunt, William C. MS; Pardilla, Marla MSW, MPH; Key, Charles R. MD, PhD «Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993». Journal of Occupational & Environmental Medicine, vol. 42, 3, Març 2000, pàg. 278–283. DOI: 10.1097/00043764-200003000-00008. PMID: 10738707.
- ↑ 38,0 38,1 Brugge, Doug; Goble, Rob «The History of Uranium Mining and the Navajo People». American Journal of Public Health. Ajph.org, vol. 92, 9, 2002, pàg. 1410–9. DOI: 10.2105/AJPH.92.9.1410. PMC: 3222290. PMID: 12197966.
- ↑ Glaser, Alexander and von Hippel, Frank N. «Thwarting Nuclear Terrorism». Scientific American, vol. 294, 2, Febrer 2006, pàg. 56–63. DOI: 10.1038/scientificamerican0206-56. PMID: 16478027.
- ↑ «History/Origin of Chemicals». NASA.
- ↑ Biever, Celeste «First measurements of Earth's core radioactivity». . New Scientist, 27-07-2005.
- ↑ «Potassium-40 heats up Earth's core». physicsweb, 07-05-2003.
- ↑ Min, M; Xu, H; Chen, J; Fayek, M «Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China». Ore Geology Reviews, vol. 26, 3–4, 2005, pàg. 198. DOI: 10.1016/j.oregeorev.2004.10.003.
- ↑ Emsley 2001, pàg. 476 i 482.
- ↑ Macaskie, L. E.; Empson, R. M.; Cheetham, A. K.; Grey, C. P. i Skarnulis, A. J. «Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystalline HUO
2PO
4». Science, vol. 257, 5071, 1992, pàg. 782–784. Bibcode: 1992Sci...257..782M. DOI: 10.1126/science.1496397. PMID: 1496397. - ↑ Anderson, R. T.; Vrionis, H. A.; Ortiz-Bernad, I.; Resch, C. T.; Long, P. E.; Dayvault, R.; Karp, K.; Marutzky, S.; Metzler, D. R. «Stimulating the In Situ Activity of Geobacter Species To Remove Uranium from the Groundwater of a Uranium-Contaminated Aquifer». Applied and Environmental Microbiology, vol. 69, 10, 2003, pàg. 5884–5891. DOI: 10.1128/AEM.69.10.5884-5891.2003. ISSN: 0099-2240.
- ↑ Nilgiriwala, K.S.; Alahari, A.; Rao, A. S. i Apte, S.K. «Cloning and Overexpression of Alkaline Phosphatase PhoK from Sphingomonas sp. Strain BSAR-1 for Bioprecipitation of Uranium from Alkaline Solutions» (en anglès). Applied and Environmental Microbiology, vol. 74, 17, 2008, pàg. 5516–5523. DOI: 10.1128/AEM.00107-08. PMC: 2546639. PMID: 18641147.
- ↑ 48,0 48,1 «World Uranium Mining». World Nuclear Association.
- ↑ Seaborg 1968, p. 774.
- ↑ «Athabasca Basin, Saskatchewan».
- ↑ Gupta, C. K. and Mukherjee, T. K.. Hydrometallurgy in extraction processes, Volume 1. CRC Press, 1990, p. 74–75. ISBN 0-8493-6804-9.
- ↑ 52,0 52,1 52,2 «Exploration drives uranium resources up 17%». World-nuclear-news.org.
- ↑ 53,0 53,1 53,2 «Global Uranium Resources to Meet Projected Demand». International Atomic Energy Agency, 2006.
- ↑ «Supply of Uranium».
- ↑ «Uranium Mining and Processing in South Australia». South Australian Chamber of Mines and Energy, 2002.
- ↑ «Military Warheads as a Source of Nuclear Fuel». World-nuclear.org.
- ↑ «Uranium recovery from Seawater». Japan Atomic Energy Research Institute, 23-08-1999.
- ↑ «How long will nuclear energy last?», 12-02-1996.
- ↑ Tsezos, M.; Noh, S. H. «Extraction of uranium from sea water using biological origin adsorbents». The Canadian Journal of Chemical Engineering, vol. 62, 4, 1984, pàg. 559–561. DOI: 10.1002/cjce.5450620416.
- ↑ «ORNL technology moves scientists closer to extracting uranium from seawater». Oak Ridge National Laboratory, 21-08-2012.
- ↑ «Pueling nuclear power with seawater». PNNL, 21-08-2012.
- ↑ «NUEXCO Exchange Value (Monthly Uranium Spot)». Arxivat de l'original el 12 desembre 2007.
- ↑ «World Uranium Production». UxC Consulting Company, LLC.
- ↑ «Lack of fuel may limit U.S. nuclear power expansion». Massachusetts Institute of Technology, 21-03-2007.
- ↑ Deffeyes, Kenneth S.i MacGregor, Ian D.. «World Uranium Resources». Scientific American, Gener 1980.
- ↑ Seaborg 1968, p. 779
- ↑ 67,0 67,1 67,2 «Chemical Forms of Uranium». Argonne National Laboratory.
- ↑ 68,0 68,1 Seaborg 1968, p. 778
- ↑ 69,0 69,1 69,2 69,3 Puigdomènech, Ignasi. KTH Royal Institute of Technology. Hydra/Medusa Chemical Equilibrium Database and Plotting Software, 2004.
- ↑ 70,00 70,01 70,02 70,03 70,04 70,05 70,06 70,07 70,08 70,09 Seaborg 1968, p. 782
- ↑ 71,0 71,1 Seaborg 1968, p. 780
- ↑ Seaborg 1968, p. 777
- ↑ «Uranium Enrichment». Argonne National Laboratory.
- ↑ 74,0 74,1 Diehl, Peter «Depleted Uranium: a by-product of the Nuclear Chain». Laka Foundation.
- ↑ Duarte, F. J. i Hillman, L. W.. Dye Laser Principles, 1990, p. 413. ISBN 0-12-222700-X.
- ↑ «Radiation Information for Uranium». U.S. Environmental Protection Agency. [Consulta: 31 juliol 2009].
- ↑ «ToxFAQ for Uranium». Agency for Toxic Substances and Disease Registry, September 1999. [Consulta: 18 febrer 2007].
- ↑ Francis, AJ; Dodge, CJ; McDonald, JA; Halada, GP «Decontamination of uranium-contaminated steel surfaces by hydroxycarboxylic acid with uranium recovery». Environmental Science & Technology, vol. 39, 13, 2005, pàg. 5015–21. Bibcode: 2005EnST...39.5015F. DOI: 10.1021/es048887c. PMID: 16053105.
- ↑ Wu, WM; Carley, J; Gentry, T; Ginder-Vogel, MA; Fienen, M; Mehlhorn, T; Yan, H; Caroll, S; Pace, MN «Pilot-scale in situ bioremedation of uranium in a highly contaminated aquifer. 2. Reduction of u(VI) and geochemical control of u(VI) bioavailability». Environmental Science & Technology, vol. 40, 12, 2006, pàg. 3986–95. Bibcode: 2006EnST...40.3986W. DOI: 10.1021/es051960u. PMID: 16830572.
- ↑ 80,0 80,1 Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L. and Abou-Donia, M. B. «Depleted and natural uranium: chemistry and toxicological effects». Journal of Toxicology and Environmental Health Part B: Critical Reviews, vol. 7, 4, 2004, pàg. 297–317. DOI: 10.1080/10937400490452714. PMID: 15205046.
- ↑ «Toxicological Profile for Uranium» (PDF). Atlanta, GA: Agency for Toxic Substances and Disease Registry (ATSDR), September 1999.
- ↑ Hindin, Rita; Brugge, D; Panikkar, B «Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective». Environ Health, vol. 4, 2005, pàg. 17. DOI: 10.1186/1476-069X-4-17. PMC: 1242351. PMID: 16124873.
- ↑ Arfsten, D.P.; K.R. Still; G.D. Ritchie «A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development». Toxicology and Industrial Health, vol. 17, 5–10, 2001, pàg. 180–91. DOI: 10.1191/0748233701th111oa. PMID: 12539863.
- ↑ Domingo, JL; Paternain, JL; Llobet, JM; Corbella, J «The developmental toxicity of uranium in mice». Toxicology, vol. 55, 1–2, 1989, pàg. 143–52. DOI: 10.1016/0300-483X(89)90181-9. PMID: 2711400.
- ↑ «Public Health Statement for Uranium». CDC. [Consulta: 15 febrer 2007].
- ↑ Chart of the Nuclides, US Atomic Energy Commission 1968
- ↑ Dart, Richard C.. Medical Toxicology. Lippincott Williams & Wilkins, 2004, p. 1468. ISBN 0-7817-2845-2.
- ↑ 88,0 88,1 «Radiation Fact Sheets #27, Uranium (U)». Washington State Department of Health, Office of Radiation Protection, 2010. [Consulta: 23 agost 2011].
- ↑ Mulloy KB, James DS, Mohs K, Kornfeld M «Lung Cancer in a Nonsmoking Underground Uranium Miner». Environ Health Perspect, vol. 109, 3, 2001, pàg. 305–309. DOI: 10.1289/ehp.01109305. PMC: 1240251. PMID: 11333194.
- ↑ Samet JM, Kutvirt DM, Waxweiler RJ, Key CR «Uranium mining and lung cancer in Navajo men». N Engl J Med, vol. 310, 23, 1984, pàg. 1481–1584. DOI: 10.1056/NEJM198406073102301. PMC: 6717538.
- ↑ Dawson, Susan E «Navajo Uranium Workers and the Effects of Occupational Illnesses: A Case Study». Human Organization, vol. 51, 4, 1992, pàg. 389–397.
- ↑ Gilliland FD, Hunt WC, Pardilla M, Key CR «Uranium Mining and Lung Cancer Among Navajo Men in New Mexico and Arizona, 1969 to 1993». J Occup Environ Med, vol. 42, 3, 2000, pàg. 278–283. DOI: 10.1097/00043764-200003000-00008. PMID: 10738707.
- ↑ Gottlieb LS, Husen LA. «Lung cancer among Navajo uranium miners». Chest, vol. 81, 4, 1982, pàg. 449–52. DOI: 10.1378/chest.81.4.449. PMID: 6279361.
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Urani |
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||
Plantilla:Enllaç AB
Plantilla:Enllaç AD
Plantilla:Enllaç AD
Plantilla:Enllaç AD
Plantilla:Enllaç AD
