Argent
| Argent | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
47Ag
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc metàl·lic brillant Argent refinat electrolíticament  Línies espectrals de l'argent | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Argent, Ag, 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 11, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 107,8682 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d10 5s1 2, 8, 18, 18, 1 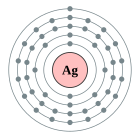
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
10,49 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
9,320 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.234,93 K, 961,78 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 2.435 K, 2.162 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 11,28 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 250,58 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,350 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 1, 2, 3 (òxid amfòter) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,93 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 731,0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 2.070 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 3.361 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 144 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 145±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 172 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 15,87 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 429 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Difusivitat tèrmica | (300 K) 174 mm²/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 18,9 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) 2.680 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 83 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 30 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 251 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 206 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-22-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops de l'argent | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'argent, conegut igualment com a plata, és l'element químic de símbol Ag i nombre atòmic 47. Està situat en el grup 11 de la taula periòdica dels elements en el 5è període, i de símbol és Ag. És un metall de transició blanc i brillant. Presenta les majors conductivitats tèrmica i elèctrica de tots els metalls. Està formant part de diferents minerals (generalment en forma de sulfur) o com a argent natiu o lliure. Té múltiples aplicacions: s'empra en l'encuny de monedes, joieria, com a catalitzador, etc., i –en forma de determinades sals– en fotografia.
Etimologia[modifica]
El mot «argent» prové del llatí argĕntum, amb el mateix significat,[2] que deriva de l'ètim grec antic ἀργήεντος - argēentos, gen. d'ἀργήεις - argēeis, 'blanc', 'lluent'. D'altra banda el seu sinònim «plata» ve de plat, en el sentit de 'plat gran', i també antigament 'planxa de metall'; aplicat a l'argent, 'planxa d'argent', a còpia de repetir-se, l'expressió acabà per reduir-se a plata com a sinònim d'argent.[3] A la península Ibèrica el terme es va especialitzar per a passar a referir-se al metall i a més del mot català origina també el portuguès prata i el castellà plata. En el català modern -segurament a causa de la pressió del castellà- la forma popular més emprada és «plata», tot i que en el català antic predominava clarament la forma «argent», com ho proven els topònims l'Argenteria (Pallars Sobirà), Argentona (Maresme), l'Argentera (Baix Camp), carrer de l'Argenteria (Barcelona, Girona, Palma, Xàtiva), carrer dels Argenters (València, Vic), que l'ofici de qui treballa l'argent s'anomena argenter (mot que és també un cognom). Els mots derivats s'han format i se segueixen formant actualment a partir de l'arrel argent: argentífer, argentita, argíria, argentimetria, etc.
Història[modifica]


L'argent es coneix des de temps remots. És mencionada en el llibre del Gènesi,[4] i acumulacions de residus trobats en forns a l'Àsia Menor i en illes del Mar Egeu, indiquen que l'argent era separat del plom al Mil·lenni IV aC. Ha estat usat des de fa milers d'anys com a ornament i per a fabricar estris. Fou considerat durant molt temps el segon metall preciós, només per darrere de l'or. En l'antiguitat existien diversos sistemes monetaris, i Alexandre el Gran unificà el sistema monetari basat en l'argent com a moneda forta seguint els ensenyaments d'Aristòtil.[5] A la seva mort el sistema es trencà, i els romans amb el temps n'establiren un basat en el bronze que inclogué l'argent posteriorment.[5] Amb la caiguda de la República Romana el sistema es deteriorà fins que Juli Cèsar establí un sistema basat en l'or i l'argent. Progressivament la quantitat d'argent de les monedes s'anà rebaixant del 100 % fins al 4 % durant el regnat de Gal·liè,[5] i després de la Caiguda de l'Imperi Romà d'Occident les monedes com a base d'intercanvi comercial desaparegueren de bona part d'Europa.[5]
Associada amb la Lluna, així com amb la mar i diverses deesses lunars, el metall era anomenat pels alquimistes luna, i un dels símbols usats per a representar el metall, era una lluna creixent, amb la part oberta cap a l'esquerra. El metall mercuri, es pensava que era un tipus d'argent, tot i que els dos elements són químicament diferents. Els nom hydrargyrum ("argent d'aigua") i el nom en anglès quicksilver en són dos exemples.
Les colònies europees al Nou món, varen fer grans extraccions d'aquest metall a Zacatecas, Mèxic i al Potosí, generant una gran riquesa al continent europeu. El riu de la Plata i l'Argentina deuen el seu nom a aquest metall, i la paraula “plata” és usada a Amèrica Llatina per referir-se als diners.

Abundància i obtenció[modifica]
L'argent és un element poc abundant, ocupa la posició 66a en quan a abundància dels elements químics a l'escorça terrestre, amb una concentració mitjana als sòls de 0,5 ppm.[6] L'argent es troba en forma nativa, combinat amb sofre, arsènic, antimoni, o clor. Els minerals que en contenen més d'un 75 % són: l'argent natiu (100 %); al·largent (98,87 %); acantita (87,06 %); argentita (87,06 %); aguilarita (79,53 %); argirodita (76,51 %); i clorargirita (75,26 %). En total s'han descrit 167 minerals que contenen argent.[7]
| |||||||||||||||||||||||||||||||||
| Font: United States Geological Survey (USGS) - 2020 |
| ||||||||||||||||||||||||||||||||||||
| Font: United States Geological Survey (USGS) - 2020 |
Tanmateix l'argent s'obté com a producte secundari de les menes de coure, coure-níquel, or, plom i plom-zinc obtingudes al Canadà, Mèxic, el Perú i els Estats Units. Com que la major part dels jaciments d'argent, són al continent americà, l'argent era molt més valuós abans del descobriment d'aquesta. Anteriorment a la colonització d'Amèrica, l'argent tenia entre una sisena part i una setena part del valor de l'or. Actualment l'argent és comparativament molt més barat, costant aproximadament una seixantena part del valor de l'or.
L'argent de grau comercial, conté com a mínim un 99,9% d'argent. Es pot obtenir argent amb pureses superiors al 99,999%. S'anomena argent de llei o de 1a llei, la que té un 92,5% d'argent i un 7,5% de coure (en joieria s'anomena argent de 925 mil·lèsimes). La de 2a llei té 800 mil·lèsimes (80 % d'argent i 20 % de coure).[8]
Producció minera[modifica]
La producció mundial d'argent durant el 2019 assolí un total de 27 000 tones mètriques. Els principals països productors són Mèxic, el Perú i la Xina que representen per si sols la meitat de la producció mundial. Durant les darreres dècades s'ha produït una disminució degut a la reducció dràstica de la demanda en material fotogràfic.[9]

D'acord amb informació lliurada en l'informe anual del United States Geological Survey (USGS), les estimacions assenyalen que les reserves conegudes d'argent a principis del 2020 a nivell mundial arribarien 560 000 tones mètriques. I segons les estimacions d'USGS, al Perú existirien l'ordre de 120 000 tones mètriques econòmicament explotables, equivalents al 21 % del total de reserves mundials del mineral, seguit de Polònia amb 100 000 tones mètriques econòmicament explotables, equivalents al 18 % del total de reserves mundials del mineral.[9]
Propietats[modifica]
Propietats físiques[modifica]

L'argent és un metall de densitat 10,50 g/cm³, punt de fusió 961,78 °C i punt d'ebullició 2162 °C. És un metall de lluïssor metàl·lica blanca, molt dúctil i mal·leable, lleugerament més dur que l'or. Presenta la més alta conductivitat elèctrica de tots els metalls, fins i tot superior a la del coure, tot i que el seu major cost ha impedit que el substitueixi en aplicacions elèctriques. Entre els metalls, també és l'argent pur el que té la conductivitat tèrmica més elevada[10] (el no-metall diamant i el superfluid heli II la tenen més alta) i una de les reflectivitats òptiques més elevades[11] (l'alumini supera lleugerament l'argent en parts de l'espectre visible, i l'argent no és un bon reflector de la llum ultraviolada). L'argent també té la resistència de contacte més baixa de qualsevol metall.

Propietats químiques[modifica]
L'argent és estable en l'aire i l'aigua quan són purs, però es desllustra quan se l'exposa a aire o aigua que contenen ozó o sulfur d'hidrogen, formant una capa negra de sulfur d'argent que es pot netejar amb àcid clorhídric diluït.[12] Els halurs d'argent (fluorur d'argent, clorur d'argent, bromur d'argent, iodur d'argent) són fotosensibles i destaquen per la seva capacitat d'enregistrar una imatge latent que més tard pot ser revelada químicament. L'estat d'oxidació més habitual de l'argent és +1 (per exemple, en el nitrat d'argent: ); a més, es coneixen compostos amb nombre d'oxidació +2 (per exemple, el fluorur d'argent(II): ) i alguns compostos amb +3 (per exemple, tetrafluoroargentat de potassi: ).

L'argent es dissol fàcilment en àcid nítric per generar nitrat d'argent , un sòlid cristal·lí transparent que és fotosensible i fàcil de dissoldre en aigua. El nitrat d'argent es fa servir com a punt inicial per la síntesi de molts altres compostos d'argent, com a antisèptic i com a tinció groga en vitralls. L'argent no reacciona amb l'àcid sulfúric, que es fa servir en l'orfebreria per netejar i eliminar les taques d'òxid de coure dels objectes fets d'argent després de la soldadura o la recuita d'argent. Tanmateix, l'argent reacciona fàcilment amb el sofre o el sulfur d'hidrogen per generar sulfur d'argent , un compost de color fosc, familiar per ser el desllustrat que apareix a les monedes i altres objectes d'argent. El sulfur d'argent també forma barbes d'argent quan s'utilitzen connectors elèctrics d'argent en una atmosfera rica en sulfur d'hidrogen.
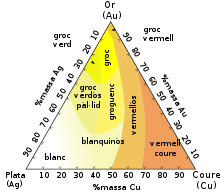
La plata s'alia fàcilment amb gairebé tots els metalls, excepte amb el níquel, que ho fa amb dificultat, i amb el ferro i el cobalt amb els quals no s'alia. Fins i tot a temperatura ordinària forma amalgames amb mercuri. L'aliatge d'argent i coure (a vegades argent amb estany, zinc o altres metalls no preciosos) s'anomena billó. S'havia emprat en l'encuny de moneda. L'aliatge d'argent i or s'anomena electre. El metall d'aliatge per excel·lència és el coure que endureix l'argent fins a continguts del 5 % (que es coneix com a plata de llei), encara que s'han utilitzat aliatges amb continguts més grans de coure. Les addicions de coure no alteren el color de l'argent fins i tot fins a continguts del 50 %, encara que en aquest cas el color es conserva en una capa superficial que en desgastar-se mostrarà un aliatge de color vermellós, més acusat com més gran sigui la quantitat de coure. També s'han usat aliatges amb cadmi en joieria, ja que aquest element li confereix a l'aliatge una ductilitat i mal·leabilitat adequats per al treball del metall.
Isòtops[modifica]
A la natura hom troba dos isòtops estables d'argent, i , dels quals l'argent 107 és el més abundant (51,839%). Se n'han caracteritzat vint-i-vuit radioisòtops, els més estables dels quals són , amb un període de semidesintegració de 21,29 dies, amb un de 7,45 dies i amb un de 3,13 hores. Tots els isòtops radioactius restants tenen períodes de semidesintegració menors d'una hora i la majoria de menys de 3 minuts. Aquest element, té també nombrosos meta estats, el més estable dels quals és Ag-128m (t* de 418 anys), Ag-110m (t* 249,79 dies) i Ag-107m (t* 8,28 dies).
Els isòtops de l'argent, varien entre una massa atòmica relativa de 93,943 (Ag-94) a 123,929 (Ag-124). El mode de decaïment principal dels isòtops anteriors al més estable (Ag-107) és la captura electrònica, convertint-se principalment en pal·ladi (element 46). Els isòtops més grans, se solen desintegrar per desintegració beta convertint-se en isòtops de cadmi (element 48).
Aplicacions[modifica]
Els usos principals de la plata, són com a metall preciós, i les seves sals halogenes, especialment el nitrat de plata (AgNO₃). La plata és també àmpliament usada en fotografia, la seva aplicació d'un sol ús més freqüent.
Altres usos de la plata són els següents;
- Productes elèctrics i electrònics, que necessiten la gran conductivitat elèctrica, fins i tot quan estan oxidats superficialment. Per exemple els circuits impresos estan fets usant pintures de plata, i els teclats dels ordinadors usen contactes elèctrics de plata. Se'n van fer servir 13.540 tones en la fabricació dels electroimants utilitzats per enriquir urani durant la Segona Guerra Mundial (principalment a causa de l'escassetat de coure durant el conflicte).[13][14] Una altra excepció notable són els cables d'àudio alts de gamma.[15]
- Miralls que requereixen una gran reflectivitat per a la llum visible, són realitzats en plata. Els miralls comuns són realitzats d'alumini.
- La plata s'ha utilitzat per a encunyar moneda des del segle vii aC, pels lidis en la forma d'electre. Més tard, la plata pura fou refinada i encunyada.
- La plata és usada per la seva bellesa en la fabricació de joieria i plateria, la qual és tradicionalment realitzada usant un aliatge de plata amb una riquesa del 92,5%.
- La mal·leabilitat, no toxicitat i bellesa de la plata, la fa útil en aliatges per a pròtesis dentals.
- Les propietats catalítiques de la plata, la fan ideal per a la utilització com a catalitzador en reaccions d'oxidació. Per exemple, la producció de formaldehid utilitzant metanol i aire utilitza pantalles de plata o cristallita contenint almenys un 99,95% en pes de plata.
- És usada per a fer materials per a soldadura, contactes elèctrics, i bateries d'alta capacitat; de plata-zinc i de plata-cadmi.
- El sulfur de plata, és format quan els contactes elèctrics de plata s'exposen a una atmosfera rica en sulfur d'hidrogen.
- El fulminat de plata és un poderós explosiu
- El clorur de plata (AgCl), es pot fer transparent, i s'utilitza com a ciment per al vidre.
- El iodur de plata, s'ha utilitzat per a intentar crear núvols per a produir pluja.
- En les llegendes, la plata és tradicionalment perjudicial per a criatures sobrenaturals, com els homes llops i els vampirs. S'utilitza la plata per a realitzar bales per a armes de foc per a matar aquestes criatures.
- L'òxid de plata s'utilitza com a elèctrode positiu en les piles per a rellotges.
- El nitrat de plata (en dissolució) i la crema de sulfadiazina de plata (Crema SSD) fou utilitzat com a tractament antibiòtic/antibacterià per a cremades greus fins a la fi del segle xx.
Metall preciós[modifica]

L'ús més conegut de la plata és com a metall preciós. El contrast entre l'aparença del seu color blanc i gran lluentor i les qualitats òptiques de la majoria d'altres medis fa que sigui molt útil per les arts visuals. Se l'ha utilitzat des de fa molt de temps per donar un gran valor monetari als objectes (com ara monedes de plata) o per fer que simbolitzin un rang social o polític elevat (com per exemple medalles de plata).
Moneda[modifica]
La plata, en forma d'electre (un aliatge de plata i or) era utilitzada per encunyar monedes als voltants del 700 aC pels lidis. Més endavant, la plata va ser refinada i encunyada en la seva forma pura. Moltes nacions utilitzaven la plata com a unitat bàsica de valor monetari. Al món d'avui en dia, el lingot de plata té el codi de moneda ISO XAG. El nom de la moneda del Regne Unit, "lliura", reflecteix el fet que originalment representava el valor d'una unça de plata de llei (plata "esterlina"). Al segle xix, molts països, incloent-hi els Estats Units i el Regne Unit, feren el canvi de l'estàndard de plata al patró or pel valor monetari, i al segle xx canviaren a la moneda fiduciària amb la fallida del sistema de Bretton Woods.[16]
Joieria i argenteria[modifica]
Les joies i l'argenteria estan fetes tradicionalment de plata de llei (plata estàndard), un aliatge d'un 92,5% de plata amb un 7,5% de coure. Als Estats Units només es pot vendre com a "plata" un aliatge que tingui com a mínim un 92,5% de plata fina. La plata de llei és més dura que la plata pura, i té un punt de fusió més baix (893 °C) que la plata pura o el coure pur.[12] La plata Britànnia és un estàndard alternatiu de qualitat de contrast que conté un 95,8% de plata, i sovint es fa servir per produir coberts de plata i plats llavorats. Amb l'addició de germani es forma, l'aliatge modificat patentat anomenat «plata de llei Argentium», que té propietats millorades com per exemple la resistència a les taques de foc.
Reactors nuclears[modifica]
Com que la plata absorbeix neutrons lliures amb facilitat, se l'utilitza habitualment per manufacturar barres de control que regulen la reacció de fissió en cadena en reactors nuclears d'aigua a pressió, generalment en forma d'un aliatge que conté un 80% de plata, un 15% d'indi i un 5% de cadmi.
Medicina[modifica]
Els ions i els compostos de plata tenen un efecte tòxic sobre alguns bacteris, virus, algues i fongs, propietat típica dels metalls pesants com el plom o el mercuri, però sense l'alta toxicitat pels humans que normalment està associada amb aquests altres metalls. Els seus efectes germicides maten molts microbis in vitro, però les proves i l'estandardització dels productes de plata resulten difícils.[17]
Hipòcrates, el "pare de la medicina",[18][19][20] escrigué que la plata tenia propietats beneficioses curatives i contra les malalties, i els fenicis solien emmagatzemar l'aigua, el vi i el vinagre en ampolles de plata per evitar que es fessin malbé. A principis del segle xix, la gent posava monedes de plata a les ampolles de llet per perllongar-ne la frescor.[21] Els seus efectes germicides n'incrementaren el valor en els utensilis i la joieria. El mecanisme exacte de l'efecte germicida de la plata encara no està ben comprès, tot i que existeixen teories que intenten explicar-lo. Una d'elles és la teoria de l'efecte oligodinàmic, que explica l'efecte de la plata sobre els microorganismes però que no explicaria l'efecte sobre els virus.
Es feien servir compostos de plata per evitar infeccions a la Segona Guerra Mundial abans del descobriment dels antibiòtics. Les dissolucions de nitrat de plata eren un tractament estàndard, però foren substituïdes per les cremes de sulfadiazina de plata,[22] que fou generalment el tractament estàndard pel tractament antibacterià i antibiòtics de cremades greus fins a la fi del segle xx.[23] Avui en dia, es fan servir altres opcions, com per exemple els apòsits amb revestiment de plata (apòsits de plata activada), juntament amb la crema de sulfadiazina de plata. Tanmateix, els estudis sobre l'eficacitat d'aquests apòsits tractats amb plata han donat resultats variats, i tot i que els resultats són prometedors, estan espatllats per la mala qualitat de les proves utilitzades per avaluar aquests productes.[24] Una revisió sistemàtica duta a terme per la Cochrane Collaboration no trobà proves suficients per recomanar l'ús d'apòsits tractats amb plata per tractar ferides infectades.[24]
Des de fa molt de temps s'ha sabut que l'acció antibacteriana de la plata és millorada per la presència d'un camp elèctric. L'aplicació d'uns quants volts d'electricitat per elèctrodes de plata millora significativament la velocitat a la qual moren els bacteris de la dissolució. Es descobrí recentment que l'acció antibacteriana dels elèctrodes de plata millora molt si els elèctrodes estan coberts de nanobarres de plata.[25]
Medicaments[modifica]
Avui en dia es venen diversos tipus de compostos d'argent, o dispositius per fer dissolucions o col·loides que continguin argent, com a remeis per una gran varietat de malalties. Tot i que la majoria de preparacions d'argent col·loidal són innòqües, algunes persones que feien servir aquestes dissolucions casolanes en excés han acabat desenvolupant argíria després de mesos o anys.[26] Dosis elevades d'argent col·loidal poden resultar en coma, edema pleural i hemòlisi.[27]
L'argent té un ús estès en gels tòpics i és impregnada en benes a causa de la seva activitat antimicrobiana d'espectre ampli. Les propietats antimicrobianes de l'argent són degudes a les propietats químiques de la seva forma ionitzada, Ag+. Aquest ió forma forts enllaços moleculars amb altres substàncies que els bacteris utilitzen per respirar, com ara molècules que contenen sofre, nitrogen i oxigen.[28] Quan l'ió Ag+ forma un complex amb aquestes molècules, esdevenen inservibles pels bacteris, deprivant-los de compostos necessaris i finalment causant-ne la mort.
Precaucions i efectes nocius[modifica]
La plata, no desenvolupa cap paper conegut en l'organisme humà, i els possibles efectes beneficiaris d'aquesta són tema de discussió entre els científics. La plata metàl·lica no és tòxica, però moltes de les seves sals ho són, i algunes d'elles poden ser carcinògenes. La plata i els compostos que contenen plata (com ara la plata col·loidal) poden ser absorbits pel sistema circulatori i quedar-se dipositats en diversos teixits del cos, produint una malaltia anomenada argíria que resulta en una pigmentació blava-grisosa de la pell, els ulls i les membranes mucoses. Tot i que aquest trastorn no té cap altre efecte nociu sobre la salut de l'individu, és molt antiestètic i habitualment és permanent. L'argíria és rara, i les formes lleus es poden confondre amb cianosi.[12]
Referències[modifica]
- ↑ Magnetic susceptibility of the elements and inorganic compounds a Lide, D. R. CRC Handbook of Chemistry and Physics (en anglès). 86a edició. CRC Press, 2005. ISBN 0-8493-0486-5.
- ↑ «GDLC - argent». [Consulta: 1r juny 2020].
- ↑ «GDLC - plata». [Consulta: 1r juny 2020].
- ↑ «23:15-16». A: Gènesi.
- ↑ 5,0 5,1 5,2 5,3 Lewis, Nathan. Gold: The Once and Future Money (en anglès). John Wiley & Sons, 2012. ISBN 1118428684.
- ↑ Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ «Mineral Species sorted by the element Ag Silver». [Consulta: 3 juny 2020].
- ↑ Manual del policía. 4a. ed. Las Rozas (Madrid): La Ley, 2004. ISBN 84-9725-537-2.
- ↑ 9,0 9,1 United States Geological Survey (USGS). «La producció de plata al món el 2019». Mineral Commodity Summaries 2020, gener 2020.
- ↑ William M. Haynes. CRC handbook of chemistry and physics (en anglès). 93rd edition. Boca Raton, FL: CRC Press, 2016. ISBN 978-1-4398-8050-0.
- ↑ Edwards, H.W.; Petersen, R.P. «Reflectivity of evaporated silver films» (en anglès). Phys. Rev., 9, 1936, pàg. 871.
- ↑ 12,0 12,1 12,2 C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81th edition (en anglès). CRC press, 2000. ISBN 0849304814.
- ↑ Nichols, Kenneth D.. The Road to Trinity. Morrow (Nova York): Morrow, 1987, p. 42. ISBN 068806910X.
- ↑ «Eastman at Oak Ridge - Dr. Howard Young» (en anglès). [Consulta: 6 juny 2009].
- ↑ Oman, H. «Not invented here? Check your history» (en anglès). Aerospace and Electronic Systems Magazine, 7, 1, 1992, pàg. 51–53. DOI: 10.1109/62.127132.
- ↑ Sutton, Michael. France and the Construction of Europe, 1944-2007 (en anglès). Berghahn Books, 2007, p. 217. ISBN 184545393X.
- ↑ Chopra I. «The increasing use of silver-based products as antimicrobial agents: a useful development or a cause for concern?» (en anglès). The Journal of antimicrobial chemotherapy, 59, 4, 2007, pàg. 587–90. DOI: 10.1093/jac/dkm006. PMID: 17307768.
- ↑ Useful known and unknown views of the father of modern medicine, Hippocrates and his teacher Democritus., U.S. National Library of Medicine (en anglès)
- ↑ Hippocrates Arxivat 2009-10-29 a Wayback Machine., Microsoft Encarta Online Encyclopedia 2006. Microsoft Corporation. (en anglès)
- ↑ Strong, W.F.; Cook, John A. «Reviving the Dead Greek Guys» (en anglès). Global Media Journal, Indian Edition, Juliol 2007. ISSN 1550-7521.
- ↑ «Antibacterial effects of silver» (en anglès).
- ↑ Chang TW, Weinstein L «Prevention of herpes keratoconjunctivitis in rabbits by silver sulfadiazine» (en anglès). Antimicrob. Agents Chemother., 8, 6, 1975, pàg. 677–8. PMC: 429446. PMID: 1211919.
- ↑ ; Costagliola, M; Hayek, SN; Dibo, SA «Effect of silver on burn wound infection control and healing: review of the literature» (en anglès). Burns: journal of the International Society for Burn Injuries, 33, 2, 2007, pàg. 139–48. DOI: 10.1016/j.burns.2006.06.010. PMID: 17137719.
- ↑ 24,0 24,1 Lo SF, Hayter M, Chang CJ, Hu WY, Lee LL «A systematic review of silver-releasing dressings in the management of infected chronic wounds» (en anglès). Journal of clinical nursing, 17, 15, 2008, pàg. 1973–85. DOI: 10.1111/j.1365-2702.2007.02264.x. PMID: 18705778.
- ↑ O. Akhavan and E. Ghaderi «Enhancement of antibacterial properties of Ag nanorods by electric field» (pdf de descàrrega gratuïta) (en anglès). Sci. Technol. Adv. Mater., 10, 2009, pàg. 015003. DOI: 10.1088/1468-6996/10/1/015003.[Enllaç no actiu]
- ↑ Fung MC, Bowen DL «Silver products for medical indications: risk-benefit assessment» (en anglès). Journal of toxicology. Clinical toxicology, 34, 1, 1996, pàg. 119–26. DOI: 10.3109/15563659609020246. PMID: 8632503.
- ↑ Wadhera A, Fung M «Systemic argyria associated with ingestion of colloidal silver» (en anglès). Dermatology online journal, 11, 1, 2005, pàg. 12. PMID: 15748553.
- ↑ Slawson RM, Van Dyke MI, Lee H, Trevors JT «Germanium and silver resistance, accumulation, and toxicity in microorganisms» (en anglès). Plasmid, 27, 1, 1992, pàg. 72–9. DOI: 10.1016/0147-619X(92)90008-X. PMID: 1741462.
Enllaços externs[modifica]
- Imatges de minerals de plata
- WebElements.com – Plata (anglès)
- Mètodes per obtenir plata a la Sud-amèrica de l'època colonial (castellà)
Vegeu també[modifica]
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||








![{\displaystyle {\ce {K[AgF4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/84774e869749028b7b526df1e07ffb2c2ceb462f)