Calcita
 Cristall de calcita | |
| Fórmula química | CaCO₃ |
| Epònim | calç |
| Nom IUPAC | carbonat de calci |
| Classificació | |
| Categoria | carbonats |
| Nickel-Strunz 10a ed. | 05.AB.05 |
| Nickel-Strunz 9a ed. | 5.AB.05 |
| Nickel-Strunz 8a ed. | V/B.02 |
| Dana | 14.1.1.1 |
| Heys | 11.4.1 |
| Propietats | |
| Sistema cristal·lí | trigonal |
| Hàbit cristal·lí | cristal·lí, granular, estalactític, concrecionari, massiu, romboedral |
| Estructura cristal·lina | a = 4.9896(2) Å, c = 17.0610(11) Å; Z = 6 |
| Grup puntual | trigonal 32/m |
| Color | incolor, blanc, groc, marró, vermell, blavós a negre |
| Macles | en pot presentar, simples o múltiples |
| Exfoliació | molt bona |
| Fractura | concoidal |
| Tenacitat | fràgil |
| Duresa | 3 |
| Lluïssor | vítria |
| Color de la ratlla | blanca |
| Diafanitat | transparent (espat d'Islàndia) o translúcida |
| Gravetat específica | 2.71 |
| Densitat | 2,6 a 2,8 |
| Propietats òptiques | uniaxial (-) |
| Índex de refracció | nω = 1.640-1.660 nε = 1.486 |
| Birefringència | δ = 0,154 a 0,174 |
| Fluorescència | pot tenir-ne vermella, blava, groga, i d'altres colors sota ona curta i ona llarga |
| Solubilitat | soluble en àcids diluïts |
| Impureses comunes | de vegades, en coves, masses botrioidals |
| Altres característiques | fosforescència |
| Més informació | |
| Estatus IMA | mineral heretat (G) |
| Símbol | Cal |
| Referències | [1][2] |
La calcita és un mineral de la classe dels carbonats que pertany i dona nom al grup de la calcita.[3] És el polimorf més estable del carbonat de calci (CaCO₃); els altres polimorfs són l'aragonita i la vaterita. L'aragonita es transforma en calcita a temperatures entre els 380 i 470 °C,[4] mentre que la vaterita és encara menys estable. La calcita es pot reconèixer fàcilment per l'efervescència que sempre produeix amb certs àcids, com ara l'àcid clorhídric o el vinagre, així com per la seva duresa. Presenta diverses coloracions molt variades que reflecteixen l'àmplia composició química que pot tenir (sobretot els ions que poden trobar-se com a impureses). El mineral té una àmplia distribució a escala global i és emprat per a diferents usos, des de lents fins a materials de construcció.
Plini el Vell la va anomenar així ja l'any 79, del llatí calx, «calç viva». A vegades s'utilitza com a sinònim «pedra calcària», per bé que la calcària és en realitat la roca formada majoritàriament per calcita.
Etimologia[modifica]
El nom de «calcita» va ser introduït l'any 1849 pel mineralogista austríac Wilhelm Karl von Haidinger; ho va fer combinant la paraula alemanya Calcit i el sufix -ita (en alemany -it) que és habitualment emprat per a anomenar minerals. La paraula calcit derivava del llatí calx (que en català vol dir «calç»).[5] Plini el Vell ja va anomenar calx a la calcita l'any 79 dC. El terme «alabastre» és també utilitzat per arqueòlegs i professionals del comerç de pedra per a referir-se a una varietat de calcita de gra fi que apareix en dipòsits bandejats. Aquest terme no manté relació amb el terme «alabastre» per referir-se a la varietat de guix.[6]
Classificació[modifica]
Segons la classificació de Nickel-Strunz, la calcita pertany a «05.AB: Carbonats sense anions addicionals, sense H₂O, alcalinoterris (i altres M2+)» juntament amb els següents minerals: gaspeïta, magnesita, otavita, rodocrosita, siderita, smithsonita, esferocobaltita, ankerita, dolomita, kutnohorita, minrecordita, aragonita, cerussita, estroncianita, witherita, vaterita, huntita, norsethita, alstonita, olekminskita, paralstonita, baritocalcita, carbocernaïta, benstonita i juangodoyita. Segons la classificació de Dana la calcita és un carbonat classificat en el grup 14.1.1.1: Carbonats anhidres normals de fórmula A(XO₃).
Grup de la calcita[modifica]
El grup de la calcita està format per vuit espècies de minerals nitrats i carbonats, de cations monovalents i divalents relativament petits, entre els quals trobem Li, Ni, Na, Mg, Ca, Fe2+, Zn, Co2+, i Cd.[3]
| Espècie | Fórmula |
|---|---|
| Calcita | CaCO₃ |
| Esferocobaltita | CoCO₃ |
| Gaspeïta | NiCO₃ |
| Magnesita | MgCO₃ |
| Otavita | CdCO₃ |
| Rodocrosita | MnCO₃ |
| Siderita | FeCO₃ |
| Smithsonita | ZnCO₃ |
Minerals relacionats[modifica]
A més a més dels minerals que constitueixen el grup de la calcita, aquesta es troba relacionada químicament i estructural amb altres minerals. Generalment, aquests minerals, són els que es troben classificats dins del grup 5.AB en la classificació de Nickel-Strunz: Carbonats sense anions addicionals i sense aigua i, dins d'aquest grup, carbonats amb elements alcalinoterris (i altres M2+).[7] La següent taula conté una llista dels minerals relacionats:




5.AB.05 - Gaspéïta - NiCO₃
5.AB.05 - Magnesita - MgCO₃
5.AB.05 - Otavita - CdCO₃
5.AB.05 - Rodocrosita - MnCO₃
5.AB.05 - Siderita - FeCO₃
5.AB.05 - Smithsonita - ZnCO₃
5.AB.05 - Esferocobaltita - CoCO₃
5.AB.10 - Ankerita - Ca(Fe2+,Mg)(CO₃)₂
5.AB.10 - Dolomita - CaMg(CO₃)₂
5.AB.10 - Kutnohorita - Ca(Mn,Mg,Fe)(CO₃)₂
5.AB.10 - Minrecordita - CaZn(CO₃)₂
5.AB.15 - Aragonita - CaCO₃
5.AB.15 - Cerussita - PbCO₃
5.AB.15 - Estroncianita - SrCO₃
5.AB.15 - Witherita - BaCO₃
5.AB.20 - Vaterita - CaCO₃
5.AB.25 - Huntita - CaMg₃(CO₃)₄
5.AB.30 - Norsethita - BaMg(CO₃)₂
5.AB.35 - Alstonita - BaCa(CO₃)₂
5.AB.40 - Olekminskita - Sr(Sr,Ca,Ba)(CO₃)₂
5.AB.40 - Paralstonita - BaCa(CO₃)₂
5.AB.45 - Baritocalcita - BaCa(CO₃)₂
5.AB.50 - Carbocernaïta - (Ca,Na)(Sr,Ce,Ba)(CO₃)₂
5.AB.55 - Benstonita - Ba₆Ca₆Mg(CO₃)13
5.AB.60 - Juangodoyita - Na₂Cu(CO₃)₂
Identificació[modifica]
De visu[modifica]


A causa de l'efervescència que sempre produeix amb els àcids, s'ha comprovat que una de les maneres més efectives per identificar la calcita és el test de l'àcid, en el qual es recomana utilitzar l'àcid clorhídric diluït o el vinagre. Un exemple de l'ús d'aquest test és la verificació de si un ciment de gres o de conglomerat és de calcita o no, ja que en el cas que faci efervescència es podrà afirmar que el ciment conté aquest mineral és calcític. El motiu d'aquest fet és la següent reacció química, en la qual el diòxid de carboni produeix bombolles en escapar-se en forma de gas: CaCO₃ + 2H+ → Ca+2 + H₂O + CO₂ (g). Per a realitzar el test, és important que l'àcid clorhídric es trobi concentrat al 10%; això és degut al fet que en concentracions superiors, l'àcid també pot fer bullir algunes dolomies (formades per dolomita), i per tant comportar confusió. A més a més del test de l'àcid, la calcita es pot identificar per la seva duresa, podent-se ratllar amb una moneda de coure. A causa de la seva duresa (duresa = 3), va ser escollit com a mineral de referència en l'escala de Mohs. La calcita sol presentar macles, tan simples com múltiples, una lluïssor vítria i una ratlla de color blanc. Pot presentar diversos colors, alguns dels quals són blanc, groc, marró, vermell, blavós o negre. El seu hàbit pot ser característic sobretot quan la calcita es troba ben cristal·litzada.
- Maclat
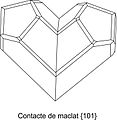
Com a mínim s'han descrit quatre lleis de maclat per als cristalls de calcita; la llei més habitual presenta un pla de maclat i de composició {0112}. També són comunes les macles en {0001} amb {0001} com a superfície composicional, produint angles reentrants. Poc comunes són les macles en {1011} o {0221} com a pla de maclat, produint el que s'anomena com a cristalls en forma de cor (maclat tipus papallona).
-
Calcita maclada segons el pla de contacte {101}
-
Calcita maclada segons el pla de contacte {012}
Amb microscopi òptic[modifica]

La calcita observada amb microscopi òptic és uniaxial amb un signe òptic negatiu; la seva orientació òptica (X|c) és difícil de determinar a conseqüència de la seva elevada birefringència.[8] Presenta una birefringència màxima de 0,174 i una extinció simètrica a les línies d'exfoliació quan el cristall es troba extingit. Presenta uns colors d'interferència d'alt ordre en polarització creuada, un relleu elevat que canvia amb la rotació i un índex de refracció menor que la dolomita. Pot presentar maclat simple i lamel·lar en algunes cares cristal·lines. Presenta exfoliació romboèdrica molt clara i perfecta, sempre visible, excepte en els agregats micrítics.[9] L'extinció de la calcita és recta en agregats columnars i simètrica en el romboedre d'exfoliació. En el microscopi també és possible observar-hi les macles polisintètiques laminars (no sempre presents) paral·leles a la diagonal major del romboedre d'exfoliació.[8]
Propietats[modifica]
Color[modifica]
La calcita pura, extremadament rara a la naturalesa, és incolora i transparent. Sovint, la calcita presenta impureses (altres elements que entren dins de la seva estructura cristal·lina); aquestes impureses poden fer variar el reu rang cromàtic. Deixant de banda l'espat d'Islàndia, la calcita sol presentar coloracions groguenques o marrons quan es troba en estat natural. Alguns dels elements que poden fer variar el seu color són el ferro, el zinc, el cobalt o el manganès.[10] Quan la calcita té ferro, aquesta presenta coloracions groguenques o marronoses (es pot comparar amb la siderita (FeCO₃)); el zinc produeix coloracions grisenques en la calcita (es pot comparar amb l'smithsonita (ZnCO₃)); el cobalt produeix coloracions rosades (es pot comparar amb l'esferocobaltita (CoCO₃)); finalment, el manganès, produeix colors violetes o rosades (es poden comparar amb la rodocrosita (MnCO₃)).[10] A partir de les següents imatges es poden comparar els minerals citats anteriorment amb diferents coloracions en la calcita:
-
Calcita marronosa (CaCO₃)
-
Siderita (FeCO₃)
-
Calcita rosada (CaCO₃)
-
Rodocrosita (MnCO₃)
-
Calcita rosada rica en cobalt (CaCO₃)
-
Esferocobaltita (CoCO₃)
-
Calcita grisenca (CaCO₃) amb pirita (mineral daurat)
-
Smithsonita (ZnCO₃)
La calcita també pot presentar coloració verda, sovint localitzada en una part dels cristalls; això es deu sovint a la presència de malaquita de color verd fosc, que, barrejada amb calcita, genera el color verd. Un exemple de calcita verda per l'acció de la malaquita es troba a l'est de l'estat de Querétaro, al centre de Mèxic. Els colors del rang entre el blau cel i el color d'espígol són sovint produïts per la radiació produïda per alguns minerals. Aquesta radiació produeix defectes en la xarxa cristal·lina; aquests defectes provoquen diferents absorcions de la llum que conseqüentment generen el color blau.[10]
-
Calcita verda procedent de Mèxic
-
Calcita amb color d'espígol
Estructura cristal·lina[modifica]


L'estructura de la calcita no és gaire complexa i, per tant, es pot entendre fàcilment observant un esquema o dibuix. Sovint es descriu com una estructura de tipus NaCl (halita) modificada. Mentre que en l'halita s'alternen els ions de sodi i de clor, en la calcita s'alternen els de calci i els carbonats (CO2−
3). A diferència de l'halita, la calcita no és un mineral cúbic com a conseqüència dels ions carbonat, que trenquen la simetria cúbica en diversos sentits; un dels quals és l'orientació de les diferents molècules de carbonat, que trenquen la simetria cúbica i transformen el cub en un romboedre (un cub amb un dels eixos variats).[11] La calcita presenta una estructura similar a tots els integrants del grup de la calcita de minerals; aquests integrants estan formats per carbonat i metalls divalents de radi inferior a 1; en aquest cas, els àtoms de carboni es troben de manera trigonal planar en el CO2−
3, mentre que els metalls divalents es troben en coordinació octaèdrica. El grup puntual de la calcita és 3m, mentre que el grup espacial és R-3c. L'estructura de la calcita pot presentar diverses variacions a elevades pressions: a 1,5 GPa es converteix en calcita-II, una varietat monoclínica P21/c amb una cel·la a = 6,334; b = =4,948; c = 8,033 i β = 107,9º. A 22 kbar, la calcita-II es converteix en calcita-III, una altra varietat monoclínica C2 amb una cel·la a = 8,746; b = 4,685; c = 8,275; β = 94,4; i Z = 6. La calcita-II i la calcita-III són relativament metaestables amb l'aragonita, la qual és estable fins a 8 GPa.[12]
La calcita és un polimorf de l'aragonita i la vaterita, sent el polimorf més estable del carbonat de calci. Tant l'aragonita com la vaterita tenen la mateixa fórmula química però una estructura cristal·lina diferent, i són més solubles: l'aragonita es transforma en calcita a 400 °C, i la vaterita (mineral molt rar), o μ-CaCO₃, és encara menys estable.[13][14] És isostructural amb la nitratina i l'otavita, i forma una sèrie de solució sòlida amb la rodocrosita.[15] Quan se sotmet un cristall o massa de calcita a difracció de raigs X, s'obtenen diferents pics d'intensitats d'energia:
| Pic (2θ) | Intensitat (%) |
|---|---|
| 3,86 | 12 |
| 3,035 | 100 |
| 2,845 | 3 |
| 2,495 | 14 |
| 2,285 | 18 |
| 2,095 | 18 |
| 1,927 | 5 |
| 1,913 | 17 |
| 1,875 | 17 |
| 1,604 | 10 |
Propietats físiques[modifica]
La calcita és un mineral de carbonat càlcic que cristal·litza en el sistema trigonal, presentant formes cristal·lines molt variables (sobretot el romboedre, forma en la qual s'exfolia fàcilment, i l'escalenoedre). Les seves macles són molt freqüents segons {1000} i {101}, en té tant de simples com de polisintètiques, a més d'agregats en druses i geodes. Té una duresa de 3 a l'escala de Mohs, i una densitat de 2,710-2,711 g/cm³. La seva lluïssor és més aviat vítria, encara que a vegades també setinada. Aquest mineral sovint presenta un aspecte transparent i opac, encara que també pot ser incolor, blanc, groc, rosa, vermell, taronja. La seva ratlla és blanca.
Propietats químiques[modifica]
La seva fórmula química és CaCO₃. Els elements que es troben a la seva estructura són el calci, el carboni i l'oxigen. Alguns elements poden entrar a la seva estructura com a impureses; alguns d'aquests elements sónː manganès, ferro, zinc, cobalt, bari, estronci, plom, magnesi, coure, alumini, níquel, vanadi, crom i molibdè. En el cas del cobalt, el Co2+ li dona una coloració rosa.[16] La calcita, com la majoria de carbonats, es dissol en la majoria d'àcids. La calcita també pot ser dissolta per diferents tipus d'aigua, depenent de diferents factors com ara la temperatura de l'aigua, el pH, i la saturació d'aquesta. Tot i que la calcita és gairebé insoluble en aigua freda, un baix pH de l'aigua pot provocar la dissolució de la calcita. La calcita presenta un rar tret, anomenat solubilitat retrògrada, en el qual esdevé menys soluble en aigua conforme la temperatura d'aquesta augmenta. Quan les condicions són bones per a la precipitació de calcita, aquesta forma ciments que emplenen fractures o porositats. Quan les condicions són bones per a la dissolució, la calcita de les fractures i la porositat s'elimina, i si les condicions favorables a la dissolució perduren en el temps, fins i tot es poden formar grans porositats com ara coves (carsts). La calcita també té una elevada reactivitat fins i tot amb àcids dèbils com el vinagre, ja que fa efervescència amb els àcids diluïts freds.
Propietats òptiques[modifica]


La calcita és un mineral transparent o translúcid que, com ja s'ha esmentat anteriorment, pot presentar una gran gamma de colors: incolor, blanc, groc, marró, vermell, blavós a negre. En làmina prima presenta colors d'interferència elevats en polarització creuada. La classe òptica és uniaxial (-). Els seus índexs de refracció són nω = 1.640-1.660 i nε = 1.486. Presenta una birefringència entre 0,154 i 0,174. Els cristalls individuals de calcita presenten la propietat òptica anomenada birefringència (refracció doble). La forta birefringència d'alguns cristalls provoca que els objectes que es mirin a través d'un tros de calcita es vegin dobles. Aquest efecte va ser descrit per primer cop pel científic danès Rasmus Bartholin l'any 1669.[17]
A més a més de birefringència, la calcita pot presentar fluorescència; en ona llarga (365 nm) sovint presenta colors roses, tot i que pot arribar a presentar els colors blanc, blanc blavós, blanc groguenc, blanc rosat, groc, groc ataronjat, taronja, vermell, violeta, rosa salmó, groc verdós, blau, blanc verdós i blau violaci.[18] En ona mitja (320 nm), la calcita sol presentar fluorescència vermella, tot i que pot presentar-ne de blanca, blanc blavós, blanc groguenc, vermell ataronjat, verd groguenc i blau verdós. En ona curta (254 nm) la calcita presenta fluorescència blava; a més a més pot presentar els colors blanc, blanc blavós, blanc groguenc, blanc rosat, groc clar, groc ataronjat, taronja, vermell, rosa, rosa salmó, verd, verdós, blavós, blanc verdós i groguenc. En tots els casos la intensitat de la fluorescència és forta.[18][19]
La calcita, a vegades, també presenta fosforescència, és a dir, que té la capacitat d'absorbir i emmagatzemar energia per a després alliberar-la en forma de llum. A vegades també presenta termoluminescència, produïda per l'alliberament de llum després de ser sotmesa a temperatures elevades. En aquest cas, la temperatura ha d'oscil·lar entre els 50 i 200 °C (temperatura bastant inferior a la temperatura d'incandescència).[19]
Cel·la unitat[modifica]
En qualsevol cristall (no només els cristalls de calcita) les molècules i els àtoms es distribueixen en xarxes regulars. La morfologia del cristall es basa principalment en aquest enreixat que està format per una repetició periòdica dels motius. Generalment és molt complicat trobar la relació entre la geometria dels motius i la del cristall. És per això que en cristal·lografia se sol emprar un altre mètode: a partir de la cel·la unitat. La cel·la unitat és la fracció espacial més petita d'un cristall que presenta totes les propietats de simetria d'aquest. En el cas de la calcita, les dimensions de la cel·la unitat són de 4,9896 Å per a l'eix a i 17,061 Å per a l'eix c (amb una ràtio a:c = 1 : 3,419).[1] Quan es donen els valors de les dimensions de la cel·la unitat, també és habitual donar el valor de Z; Z és el nombre d'unitats de fórmula que es troben a la cel·la unitat. En el cas de la calcita, la Z = 6; és a dir, que dins de la cel·la hi ha sis unitats de fórmula.[1]
Abans de l'ús dels raigs X en cristal·lografia, els eixos cristal·lins es determinaven mesurant els angles entre cares, tot escollint els angles més petits, assumint que les cares més grosses presentaven l'ordenament més bàsic. Amb aquest mètode, habitualment coincidien els valors amb els descoberts posteriorment mitjançant els raigs X. Això no passà en el cas de la calcita. Originalment a la calcita se li assignava una ràtio de cel·la c:a = 0,8543, essent c fins a quatre vegades superior al valor obtingut amb raigs X; actualment es considera que c:a = 3,419. En la majoria d'índexs de Miller de la calcita, obtinguts abans de l'aplicació dels raigs X, el valor c s'ha de multiplicar per quatre. Per exemple, l'exfoliació romboèdrica és perfecta en {1011} (en la versió antiga) i és perfecta en {1014} en la versió actual (la versió correcta i acceptada).[1]
Formació[modifica]


1: plataformes carbonatades; 2: esculls de corall

La calcita és un mineral que es forma per precipitació química mitjançant l'evaporació de solucions molt riques en hidrogencarbonat de calci o per l'extracció i l'activitat dels organismes marins i d'aigua dolça. La calcita és un mineral molt comú, ja que té una àmplia distribució per tot el planeta, i es calcula que ocupa aproximadament el 4% del pes total de l'escorça terrestre i que recobreix el 40% de la seva superfície. Se'n troben pedreres per tot el món, als sòls, a les crostes desèrtiques, a les fonts hidrotermals, als jaciments metasomàtics, a les pegmatites, a les zones de meteorització i d'oxidació, als espeleotemes i fins i tot en certes roques magmàtiques. És un component habitual de les roques sedimentàries, especialment la calcària, encara que és molt fàcil de trobar-la associada a diversos minerals com la siderita, el quars, la pirita o la fluorita. Com a mineral que es forma per precipitació, per entendre el procés d'informació, s'ha de comprendre primer el comportament del carbonat càlcic en les diferents condicions. Generalment, aquest comportament (per exemple en el cas de la calcita) ve determinat per l'equació:
+ 2HCO−
3 = CaCO
3 + H
2O + CO
2
On CaCO₃ és calcita en estat sòlid; H₂CO₃ és àcid carbònic (format per la reacció entre l'aigua i el diòxid de carboni [H₂O + CO₂ = H₂CO₃]); Ca+2 és l'ió positiu calci (catió) en solució, i HCO−
3 és l'ió negatiu (anió) hidrogencarbonat (anomenat antigament ió bicarbonat) en solució. Com a conseqüència que l'equilibri és dinàmic, les equacions CaCO₃ + H₂CO₃ = Ca+2 + 2HCO−
3 i H₂O + CO₂ = H₂CO₃ es troben estretament relacionades. Si s'augmenta el CO₂ en la segona equació, es produirà més H₂CO₃ (en cap cas prenem l'aigua com a reactiu limitant, ja que en un llac o en l'oceà es troba en enormes quantitats). Aquest increment de H₂CO₃ implicarà una dissolució de la calcita (CaCO₃). Per tant, de la mateixa manera que si augmentem el contingut de CO₂ en una aigua la calcita es dissol, si en disminuïm el contingut, la calcita precipitarà. És per aquest motiu que la calcita precipita en els casos on una aigua carregada amb CO₂ dissolt l'allibera a l'atmosfera.
Aquesta equació també ens ajuda a comprendre les condicions ambientals de precipitació de la calcita. Si observem un mapa de temperatures marines i el comparem amb les zones actuals de precipitació de calcita (vegeu les imatges), observarem que les zones de precipitació coincideixen amb les d'elevada temperatura, i se situen prop dels tròpics. Aquesta evidència s'explica perquè el CO₂, com la gran majoria dels gasos, és menys soluble a temperatures altes i més soluble a temperatures baixes. Aquest fet implica que a temperatures baixes el CO₂ dissolt en aigua tendeixi a romandre dissolt i per tant el carbonat de calci no precipiti. En canvi, a elevades temperatures, el diòxid de carboni perd solubilitat i és alliberat a l'atmosfera; en aquest cas, a conseqüència de la pèrdua de CO₂, es dona la precipitació de la calcita. Per aquesta mateixa raó, hi ha precipitació de calcita en deus calentes o termals, independentment de la seva latitud. Els augments en la pressió de càrrega fan augmentar la solubilitat dels gasos, i per tant també del diòxid de carboni; per tant, un augment de la pressió produirà una dissolució del carbonat de calci. Les algues i plantes aquàtiques o marines també tenen un paper important en la precipitació o dissolució del carbonat de calci, ja que en realitzar la fotosíntesi eliminen part del CO₂ de les aigües, i, per tant afavoreixen la precipitació de la calcita. Quan aquestes mateixes plantes moren i es descomponen, alliberen CO₂ i, per tant, afavoreixen la dissolució del carbonat càlcic. De manera general, els carbonats precipiten en contexts bàsics i es dissolen en condicions àcides.[20]
A temperatura i pressió atmosfèriques (25 °C i 1 atm), la calcita és termodinàmicament estable. En aquest context, totes les formes metaestables de carbonat de calci tendeixen a la transformació a calcita.
La calcita també pot precipitar per l'activitat dels organismes marins que formen les seves closques de carbonat càlcic i que en morir se sedimenten donant lloc a les anomenades calcàries organogèniques o bioquímiques. També es pot trobar formant part de roques formades per metamorfisme regional o de contacte de calcàries sedimentàries que es transformen en marbre per recristal·lització de la calcita (per a més informació sobre les roques constituïdes per calcita, vegeu el següent apartat).
La calcita com a mineral formador de roques[modifica]
Roques sedimentàries[modifica]
La calcita és el principal mineral no silicat formador de roques.[21] És un important formador de roques sobretot en ambients sedimentaris, tot i que puntualment té certa influència en alguns ambients ignis i metamòrfics, i també ho pot ser en ambients hidrotermals. Les principals roques constituïdes majoritàriament per calcita són algunes roques carbonatades, concretament les calcàries. Les roques calcàries solen tenir més d'un 50% de calcita, i també poden contenir altres minerals depenent del seu context de formació (argila, hematites, siderita, quars…). Si una roca calcària conté una quantitat rellevant d'argila, aquesta s'anomena marga. El terme entre la calcària i la marga sol anomenar-se margocalcària.[22] Les calcàries estan constituïdes per grans minerals de calcita. Alguns d'aquests fragments provenen de fragments esquelètics marins com ara el corall, els gastròpodes, bivalves, equinoderms, crinoïdeus, foraminífers, algues i altres organismes. També s'hi troben altres fragments com ooides, peloides, intraclasts i extraclasts. Hi ha roques calcàries que no presenten grans, sinó que es troben formades a partir d'una precipitació química de calcita; per exemple el travertí. Les roques calcàries es formen en mars i oceans càlids (en regions tropicals), sobretot en zones on hi ha un aportament sedimentari (detrític) poc important. Les roques calcàries es poden diferenciar segons el seu origen; aquest pot ser químic o biològic.
- Origen químic: en el cas d'un origen químic, la calcària es forma a partir de la precipitació del carbonat de calci dissolt en aigua amb cert contingut d'àcid carbònic (CO₂), a conseqüència de l'alta solubilitat que presenta el carbonat càlcic. Quan les aigües carregades de CO₂, alliberen el gas a l'atmosfera, es produeix una precipitació química del carbonat de calci en excés:
Ca2+ Aquest alliberament del diòxid de carboni es produeix en dos contexts diferents. El primer es dona al litoral, quan les aigües carregades en diòxid de carboni arriben a la superfície i aquest s'allibera a l'atmosfera. El segon es dona quan les aigües continentals subterrànies arriben a la superfície.
+ 2HCO−
3 = CaCO
3 + H
2O + CO
2
- Origen biològic: en el cas de l'origen biològic, són els organismes marins els que empren el carbonat de calci per a construir els seus esquelets minerals. Per a certes espècies marines, és fàcil adquirir carbonat de calci, ja que es troba de manera abundant en el mar i en alguns llacs, i a vegades fins i tot gairebé en estat de saturació. Certs organismes indueixen la precipitació de la calcita per a formar els esquelets. Quan aquests organismes moren, les restes minerals s'acumulen al fons marí. En alguns casos formen autèntics sediments que després de la diagènesi constituiran la majoria de calcàries existents actualment a la Terra.
Les roques sedimentàries que per definició presenten calcita són:
|
|
Roques ígnies[modifica]
La calcita pot ser un mineral primari (igni) o secundari (format posteriorment als processos ignis) en roques ígnies. En el primer cas, es troba en roques formades a partir de magmes relativament rics en diòxid de carboni, i sol ser un mineral tardà que cristal·litza en la matriu de la roca. En el segon cas, la calcita es forma per alteració o cristal·lització a partir de fluids hidrotermals o meteòrics. Les roques ígnies que contenen més d'un 50% de carbonat s'anomenen carbonatites.[23] La calcita també pot ser present, tot i que en menor mesura en kimberlites.[24]
Les roques ígnies que per definició presenten calcita són:
Roques metamòrfiques[modifica]
Quan qualsevol de les roques citades anteriorment és afectada per metamorfisme, es transforma en una roca metamòrfica. Si la roca original presenta quantitats rellevants de calcita o carbonat, és habitual que la roca metamòrfica que en derivi també en presenti. La roca metamòrfica més coneguda que presenta calcita és el marbre.[32] El marbre es forma a partir d'un metamorfisme que causa una recristal·lització dels carbonats preexistents. El marbre resultant presenta una espècie de mosaic tipus blocky de cristalls de carbonat. Les estructures sedimentàries de la roca original són freqüentment destruïdes, tot i que en alguns casos es conserven, i fins i tot s'han trobat fòssils en marbres. Com més pura sigui la roca calcària original, més pur serà el marbre resultant. La calcita també es troba en altres roques metamòrfiques com ara esquists[33] o fil·lites[34] carbonatades o skarns.
Localització[modifica]





La calcita és abundant arreu del món, segons algunes fonts, s'han citat més de 26.000 localitats diferents. A causa de la impossibilitat de citar totes les localitats, a continuació s'enumeren les més rellevants.
Als territoris de parla catalana[modifica]
- L'Alguer, Andorra i Catalunya
A l'Alguer s'ha descrit calcita en diferents mines del seu terme municipal, concretament en les mines Calabona, a Punta de Libezzu i al Mont Argentiera.[35] A Andorra, la calcita es pot trobar en materials al·luvials transportats pels rius, i en alguns punts de muntanya en forma de filons o vetes. Tot i això, no existeixen cites que facin una descripció detallada de la calcita a la zona.
A Catalunya s'ha descrit la calcita en diverses localitats; en algunes d'aquestes s'explota econòmicament. Els jaciments més coneguts dels quals se n'extreu aquest mineral se situen a la Bastida (Conflent), a la Torre de Cabdella (Pallars Jussà), a Rocabruna (la Garrotxa), a l'Avetera i Prats de Molló (Vallespir), a Gréixer (Berguedà), i a Manresa i Sant Vicenç de Castellet (Bages). Pel que fa a Catalunya, la calcita ha estat descrita en diferents localitats. A continuació s'enumeren les mines i pedreres més rellevants on s'ha descrit la presència de calcita a Catalunya. Aquest llistat és només orientatiu, i en cap cas descriu la totalitat de mines on s'ha descrit la calcita, sinó les més rellevants.
- Mina La Martorellense (Serra de l'Ataix), Castellví de Rosanes (el Baix Llobregat)[36]
- Pedrera Sansón, Santa Creu d'Olorda (el Baix Llobregat)[36]
- Mines de Can Palomeres, Malgrat de Mar (el Maresme)[36]
- Mina Monsant, Tordera (el Maresme)[36]
- Pedrera de Rialls, Tordera (el Maresme)[36]
- Mina i pedrera Berta, Sant Cugat del Vallès - el Papiol (el Vallès Occidental) - (el Baix Llobregat)ː calcita i calcita manganèsica.[36]
- Pedrera del Turó de Montcada, Montcada i Reixac (el Vallès Occidental)[36]
- Mina Teresita, Montcada i Reixac (el Vallès Occidental)[36]
- Pedrera la Constancia, Terrassa (el Vallès Occidental)[36]
- Pedrera dels Frares, Aiguafreda (el Vallès Oriental)[36]
- Pedreres de Gualba, Gualba (el Vallès Oriental)[36]
- Pedrera Aymar, Gualba (el Vallès Oriental)[36]
- Pedrera de Can Donadeu, Sant Fost de Campsentelles (el Vallès Oriental)[36]
- Mina Niño Jesús, Celrà (el Gironès)[36]
- Mina Victoria Eperanza, Celrà (el Gironès)[36]
- Pedrera de Can Súria, Maçanet de la Selva (la Selva)[36]
- Mines d'Osor, Osor (la Selva)[36]
- Mines del Puig de Sant Julià, Sant Julià del Llor i Bonmatí (la Selva)[36]
- Mina de Can Llebó, Sant Martí Sacalm-Susqueda (la Selva)[37]
- Mina Matagalls, Viladrau (Osona)[37]
- Mina Les Ferreres, Camprodon (el Ripollès)[37]
- Mina de la Roca del Turó (Costabona), Molló (el Ripollès)[37]
- Mines de ferro de Queralbs, Queralbs (el Ripollès)[37]
- Mina Fra Joan, Setcases (el Ripollès)[37]
- Mina Serra Mata, Toloriu (L'Alt Urgell)[37]
- Mina Eureka, la Vall Fosca (el Pallars Jussà)[37]
- Mines de Bonabé, Alt Àneu (el Pallars Sobirà)[37]
- Mina Solita, Peramea (el Pallars Sobirà)ː calcita cobàltica.[37]
- Pedrera d'Enviny, Sort (el Pallars Sobirà)[37]
- Mina de barita, Alforja (el Baix Camp)[38]
- Mines del Mas de Gallofré, l'Albiol (el Baix Camp)[38]
- Mina Santíssima Trinitat, l'Espluga de Francolí (Conca de Barberà)[38]
- Mina Atrevida, Vimbodí (la Conca de Barberà)[38]
- Mina Eugenia, Bellmunt del Priorat (el Priorat)[38]
- Mina Regia, Bellmunt del Priorat (el Priorat)[38]
- Mina Renania, Bellmunt del Priorat (el Priorat)[38]
- Mina Renania, Bellmunt del Priorat (el Priorat)[38]
- Mina San José, el Masroig (el Priorat)[38]
- Mina Linda Mariquita, el Molar (el Priorat)[38]
- Mina Serrana, el Molar (el Priorat)[38]
- Mina Ventura, el Molar (el Priorat)[38]
- Mina Balcoll, Falset (el Priorat)[38]
- Mines d'Els Closos, Morera de Montsant (el Priorat)[38]
- Mina Bessó, Ulldemolins (el Priorat)[38]
Per altra banda, la calcita també s'ha descrit en altres indrets que no formen part de cap complex miner, com ara espais naturals, camins o afloraments. A continuació s'hi troba un llistat no exhaustiu d'aquestes localitats:
- Pontons, Alt Penedès[36]
- Montjuïc, Barcelonès[36]
- Aflorament a Singuerlín, Santa Coloma de Gramenet, Barcelonès[36]
- Pedraforca, el Berguedà
- Plana de Vic, Osona[36]
- Sant Bartomeu del Grau, Osona[36]
- Els Esbornacs, Santa Eulàlia de Riuprimer, Osona[36]
- Darnius, Alt Empordà[36]
- La Vajol, Alt Empordà[36]
- Ca n'Agustí, Montagut, Garrotxa[36]
- Collada Verda, Pardines, Ripollès[37]
- Costabona, Molló, Ripollès[37]
- Pic de l'Infern, Queralbs, Ripollès[37]
- Cierco, Vilaller, Alta Ribagorça[37]
- Coll de Pal, Fontanals de Cerdanya, Cerdanya[37]
- Llívia, Cerdanya[37]
- Torà, la Segarra[37]
- Costa de l'Aguda, Torà, la Segarra[37]
- Aflorament d'ofites a la carretera C-13, Sort, Pallars Sobirà[37]
- Picamoixons, Alt Camp[38]
- Coma Fosca, Monestir de Poblet, Conca de Barberà[38]
- Roca de Ponent, Monestir de Poblet, Conca de Barberà[38]
- Sant Miquel, Monestir de Poblet, Conca de Barberà[38]
- Platges al·luvials del Delta de l'Ebre, Sant Jaume d'Enveja, Montsià[38]
- Falset, Priorat[38]
- Illes Balears, la Franja i País Valencià




L'única cita de la presència de calcita a les Illes Balears és a l'illa de Mallorca.[39] Segurament aquest no és l'únic lloc on apareix calcita en l'arxipèlag, ja que un important percentatge de les roques de Mallorca, Menorca, Eivissa i Formentera són de tipus carbonàtic o argilós.[40] A la Franja de Ponent s'ha descrit la calcita en diverses mines i pedreres, com ara la pedrera Soriana o la mina Teresa (ambdues a Estopanyà) i en alguns afloraments d'argiles de la Canyada de Beric.[41] Per la geologia de la Franja de Ponent, la calcita és present a altres localitats no presents en aquest llistat. Pel que fa al País Valencià, la calcita ha estat descrita en diferents localitats. A continuació s'enumeren les mines i pedreres més rellevants on s'ha descrit la presència de calcita al País Valencià. Aquest llistat és només orientatiu, i en cap cas descriu la totalitat de mines on s'ha descrit la calcita, sinó les més rellevants.
- Pedrera Los Serranos, Albatera (Baix Segura)[42]
- Mina San Francisco, Alfàs del Pi (Marina Baixa)[42]
- Pedreres de CEMEX, Alacant (L'Alacantí)[42]
- Pedrera San Anton, Oriola (Baix Segura)[42]
- Pedrera Peña Negra, Orxeta (Marina Baixa)[42]
- Mina Colors, Villena (Alt Vinalopó)[42]
- Pedrera Muntanya Blanca, Villena (Alt Vinalopó)[42]
- Mina Niña III, Benafer (Alt Palància)[42]
- Mina Botalaria, Borriol (Plana Alta)[42]
- Mina Les Ferreries, Borriol (Plana Alta) [42]
- Mina Jaime III, Llucena (Alcalatén)[42]
- Mina Botalaria, Borriol (Plana Alta)[42]
- Mina Esperanza, la Torre d'en Besora (Alt Maestrat)[42]
- Mina de la Cueva de la Guerra Antigua, Vilafermosa (Alt Millars)[42]
- Mina la Amorosa, Vilafermosa (Alt Millars)[42]
- Mina Noemí, Sucaina (Alt Millars)[42]
- Pedrera Tozal negro, Barxeta (la Costera)[43]
- Pedrera CEMEX, Bunyol (Foia de Bunyol)[43]
- Mina de San Francisco de Borja, Caudete de las Fuentes (Plana d'Utiel)[43]
- Mina Tuerto, Dosaigües (Foia de Bunyol)[43]
- Pedrera de la Font de l'Om, Oliva (la Safor)[43]
- Mina Virgen del Pilar, Requena (Plana d'Utiel) [43]
- Pedrera La Senyoreta, Riba-roja de Túria (Camp de Túria)[43]
- Mina Vista Alegre, Sagunt (Camp de Morvedre)[43]
- Mina Santa Isabel, Utiel (Plana d'Utiel)[43]
Per altra banda, la calcita també s'ha descrit en altres indrets que no formen part de cap complex miner, com ara espais naturals, camins o afloraments. A continuació s'hi troba un llistat no exhaustiu d'aquestes localitats:
- Moralet, Alacant, l'Alacantí[42]
- Rabassa, Alacant, l'Alacantí[42]
- Estret de Busot, Busot, l'Alacantí[42]
- Arneva, Oriola, Baix Segura[42]
- Túnel de l'AP-7, Sant Vicent del Raspeig, l'Alacantí[42]
- La Vila Joiosa, la Marina Baixa[42]
- Almenara, la Plana Baixa[42]
- Betxí, la Plana Baixa[42]
- Viver, Alt Palància[42]
- Alfarb, Ribera Alta[43]
- La Mina, Camporrobles, la Plana d'Utiel[43]
- Muntanyeta dels Sants, Sueca, Ribera Baixa[43]
- Aflorament volcànic, Caudiel, Alt Palància[43]
- Parçans occitans integrats administrativament en algun territori de parla catalana, Fenolleda i Vall d'Aran
A la Vall d'Aran s'ha descrit calcita en diverses mines, entre les quals hi ha les mines Forcall, Montoliu i Reparadora (totes tres a Naut Aran); la mina Liat (Vielha e Mijaran); les mines Solitaria i Victoria (Arres) i la mina Margalida (Bossòst).[36][37][38]
Resta del món[modifica]

A Islàndia s'han documentat espècimens de calcita a la mina Helgustadan´ama, a Reydarfjord. D'Anglaterra cal destacar els espècimens descrits a Egremont, Cumbria, Durham i Cornualla. A Alemanya destaquen els exemplars de St. Andreasberg, Harz i Freiberg, Saxònia. De Romania cal destacar la calcita de Herja i Baia Mare, i dels Estats Units la d'algunes localitats de Nova York, Michigan, Missouri, Kansas, Oklahoma, Tennessee i Arizona. De Mèxic cal fer menció a la calcita extreta d'algunes mines de Chihuahua, Guanajuato i San Luis Potosí. De Rússia cal destacar la calcita d'Al'negorsk (Krai de Primórie). De l'Àfrica se'n poden destacar exemplars de Tsumeb (Namíbia) i Katanga (Congo).[44]
El cristall de calcita més gros documentat prové d'Islàndia; aquest cristall fa 7×7×2 m i 6×6×3 m i un pes de 250 tones aproximadament.[45][46] La majoria d'extraccions de calcita provenen de països com Mèxic, Estats Units o Alemanya. A la península Ibèrica la calcita s'explota sobretot a Astúries, a Santander, a Euskadi (Mondragón), a Huelva i a Oviedo.

Minerals associats[modifica]
Per les característiques químiques, estructurals i els ambients i contexts de formació, la calcita es pot trobar associada a diferents minerals, sovint aquests minerals són carbonats o sulfats o tenen certa presència de calci. Aquests minerals són generalment: la barita, la dolomita, la fluorita, la prehnita, la pirita, el quars i la siderita. En carbonatites la calcita es pot trobar associada a minerals com la natrolita, la sodalita, l'apatita, la magnetita, la barita, la fluorita i l'ancylita. En kimberlites es pot trobar associada principalment a olivina, piroxè, flogopita, granat, ilmenita i, en menor mesura a serpentina, apatita, espinel·la i magnetita.[47]
La calcita en la història geològica: els mars de calcita[modifica]
Els mars de calcita apareixen en la història de la Terra quan els precipitats inorgànics marins de carbonat de calci eren baixos en magnesi (LMC; de l'anglès Low Magnesium Calcite), oposat als actuals rics en magnesi de l'aragonita (HMC; de l'anglès High Magnesium Calcite). Els mars de calcita alternaven amb els d'aragonita essent més prominents en els períodes Ordovicià i Juràssic. La mineralització obtinguda en aquelles èpoques encara s'aprecia.[48]
Un mar de calcita és aquell on el principal carbonat de calci inorgànic que precipita és la calcita amb baix contingut de magnesi; en contraposició, un mar d'aragonita és tot aquell mar on el principal carbonat de calci inorgànic que precipita és l'aragonita amb elevat contingut de magnesi. Com ja s'ha especificat anteriorment, durant el Paleozoic inferior i des del Mesozoic mitjà al Mesozoic superior, predominaven clarament els mars de calcita, destacant sobretot els mars de calcita de l'Ordovicià i el Juràssic.[48] Els mars d'aragonita eren freqüents al Paleozoic mitjà, al Mesozoic inferior i al Cenozoic (també en l'actualitat).[49][50][51][52][53]
Els principals efectes geològics i biològics de les condicions dels mars de calcita inclouen la ràpida i àmplia formació de terres dures carbonatades,[54][55] ooides calcítics,[56][49] ciments de calcita,[57] i la dissolució contemporània de les conquilles aragonítiques en mars càlids.[58][53] Les terres dures són molt comunes, per exemple, en els mars de calcita de l'Ordovicià i el Juràssic, i totalment absents en els mars d'aragonita del Permià.[54]
Els fòssils i organismes invertebrats que es troben en dipòsits associats a mars de calcita solen presentar conquilles primes i esquelets de calcita.[59][60][61][48] En aquests casos, alguns organismes poden presentar una capa externa de calcita i una interna d'aragonita;[55] això es dona per la ràpida dissolució que presenta l'aragonita en mars calcítics; en ser precipitada com a biomineral i no estar en contacte amb l'aigua es manté.[53] Els mars de calcita coincideixen amb èpoques de ràpida expansió del fons marí i amb condicions climàtiques tipus hivernacle (greenhouse).[61] Els centres d'expansió del fons marí a través de xemeneies hidrotermals redueixen la ràtio entre magnesi i calci en l'aigua del mar.[57] La relació del rati Mg/Ca afavoreix la precipitació de la calcita en detriment de l'aragonita. Un augment de l'expansió del fons marí implica un augment de l'activitat volcànica, així com dels nivells de diòxid de carboni de l'atmosfera i els oceans. Això influeix directament en la precipitació dels polimorfs de CaCO₃.[52]
La calcita en els éssers vius, els fòssils i els processos de fossilització[modifica]


Els processos de fossilització són complexos i presenten diferents i nombrosos estadis, des de l'enterrament fins al descobriment del fòssil. Els organismes amb parts dures com ara conquilles mineralitzades presents en trilobits o ammonites (entre d'altres organismes), presenten més opcions de ser conservats que els organismes amb només parts toves com ara les meduses o els cucs.[62] Normalment les parts conservades en fòssils són les dures, ja que les toves, constituïdes principalment per matèria orgànica es descomponen. Tot i que les parts dures poden ser destruïdes per l'acció de les onades o menjades per altres organismes com ara fongs o algues, és més fàcil que es preservin. La possibilitat que un organisme fossilitzi, augmenta si aquest ja viu en el sediment; i aquells que viuen al fons marí són més fàcilment fossilitzats que els que viuen en la columna d'aigua.[62] La calcita és un mineral que té una elevada presència en alguns organismes fòssils:
En el cas dels equinoderms, el seu teixit esquelètic es compon principalment de calcita rica en magnesi ((Ca,Mg)CO₃). Un cas curiós és el de les espícules; tot i que aquestes poden fer més de 10 centímetres de llargària, es comporten com a monocristalls quan s'observen amb llum polaritzada.[63] Els equinoderms també solen presentar els ossicles formats per material calcari. Els ossicles són elements que formen part de l'esquelet de certs equinoderms i que aporten més rigidesa i protecció. Es troben de diferents maneres en eriçons de mar, estrelles de mar, ofiuroïdeus, cogombres de mar i crinoïdeus. Els ossicles (així com les espícules, que són ossicles especialitzats) són les parts dels equinoderms que presenten una fossilització més favorable.[64] Alguns artròpodes com ara els trilobits, presentaven els exoesquelets mineralitzats, probablement a partir d'una mescla de calcita i matèria orgànica (quitina), exceptuant l'ordre Nektaspida;[65] actualment el que es coneix més detalladament és la presència de calcita en els ulls dels trilobits.[66] Els ulls dels trilobits s'han conservat en el registre fòssil perquè les lents oculars i les estructures que les envolten eren de calcita, un material difícil de descompondre. Els ulls de calcita dels primers trilobits eren una sèrie de lents hexagonals hermèticament compactes, similars als ulls compostos d'alguns artròpodes actuals. Durant aquella època hi havia grans quantitats de calcita al mar, per tant, no hi havia problemes a l'hora de formar els ulls.[67] Actualment s'han descrit tres tipus d'ulls en els trilobits, tots ells formats per calcita:
- Ulls holocroals: presents en la major part dels trilobits coneguts. Presenten fins a 15.000 lents de calcita, i la membrana de la còrnia només cobreix les que es troben juntes.[68]
- Ulls esquizocroals: aquest tipus d'ulls es consideren una innovació respecte els anteriors, i és present en els phacòfids. Presenten un menor nombre de lents (al voltant d'unes 700), però aquestes són de mida major. Cadascuna de les lents té una còrnia individual i es troben separades entre elles. La còrnia penetra a les lents.[68]
- Ulls abatocroals: només s'han descrit en el gènere Eodiscina del Cambrià. Presenten unes 70 lents de mida petita i separades entre elles amb còrnies individuals. La còrnia no penetra a les lents.[68]
-
Ull holocroal en Paralejurus sp.
-
Ull esquizocroal en Phacops sp.
-
Esquelet de Ceratarges sp.


A més a més dels trilobits, diferents espècies de crustacis i miriàpodes també utilitzen la calcita per a la gènesi dels seus exoesquelets. En aquests casos, la calcita pot arribar a suposar més del 40% de la cutícula. Pel que fa als mol·luscs amb conquilla, presenten generalment carbonat en aquesta, tot i que també poden generar conquilles d'altres materials. Hi ha diversos grups de mol·luscs que presenten conquilles carbonatades, com els bivalves, els gasteròpodes, els poliplacòfors, els ammonits o els nautiloïdeus, entre d'altres. Les conquilles calcàries són formades generalment per calcita i/o aragonita, tot i que alguns estudis també descriuen la presència de vaterita.[69][70] Els cristalls de carbonat càlcic es formen entre capes de matèria orgànica. Generalment, la closca dels mol·luscs està constituïda per diverses capes, generalment de calcita i aragonita i posseeix una microestructura especial característica de cada closca. Tot i això, les closques purament calcítiques són extremadament rares i es presenten només en bivalves del gènere Ostreoida (com per exemple Crassostrea gigas); tot i això, aquests organismes presenten el miostracum (zona d'adherència dels músculs) aragonític, com qualsevol altre bivalve.[70]
En la formació de conquilles dels mol·luscs, la closca es forma a partir d'un fluid orgànic secretat per les cèl·lules de l'organisme, aquest fluid posteriorment és calcificat. Per a la formació de conquilles, els ions calci i carbonat són essencials perquè la closca és principalment carbonatada; es considera que els ions calci són presos de l'aigua marina i dels aliments, tot i que encara hi ha controvèrsia sobre aquest tema.[70]
Els porífers, també coneguts com a esponges, són animals amb un registre fòssil present des de l'Ediacarià. Dintre del fílum s'hi poden diferenciar tres classes: Demospongiae, Hexactinellida i Calcarea. Les dues primeres presenten espícules silíciques, mentre que l'última les presenta calcàries. En el cas de les esponges de la classe Calcarea, presenten espícules biominerals de fins a 10 mm de llargada i amb formes específiques; estan formades per calcita rica en magnesi. Les espícules es troben cobertes per una espècie de beina orgànica.[71] Aquestes espícules es comporten com a individus monocristal·lins de calcita i en certa manera l'orientació cristal·logràfica està relacionada amb la morfologia. Malgrat la seva naturalesa monocristal·lina, la majoria d'espícules presenten un comportament de fractura gairebé isòtrop, gens típic dels cristalls de calcita, fet que indica una major resistència de les espícules. Cada espícula es troba formada per cèl·lules especialitzades que subministren ions minerals a cavitats extracel·lulars, on es produeix la cristal·lització a través d'un cristall nucli.[71]


Podem comparar les espícules calcítiques de les esponges calcàries amb les silíciques de la resta d'esponges i amb els equinoderms. Tot i la variació mineralògica i la diferència taxonòmica entre esponges i equinoderms, aquests biominerals comparteixen similituds respecte a la seva construcció a escales nanomètriques. A més a més, els elements esquelètics dels equinoderms s'assimilen a les espícules calcàries de les esponges, sobretot pel fet de ser, en tots dos casos, elements formats per cristalls individuals de calcita magnesiana que formen estructures complexes.[71]
Dins dels porífers s'hi troben dues espècies fòssils rellevants: els estromatopòrids i els arqueociats. Els estromatopòrids (Stromatoporida) van ser porífers que van viure entre l'Ordovicià i el Devonià, tot formant esculls amb coralls tabulats i briozous. Els estromatopòrids es presenten com a grans pilotes de carbonat càlcic, que en secció presenten una estructura semblant a la de les escleroesponges.[72] Els arqueociats (Archeociata) són un gènere extint exclusius del Cambrià inferior; eren porífers de mida petita que formaven esculls. El material esquelètic consistia en poliedres microgranulars entrellaçats, constituïts de carbonat càlcic (presumiblement calcita) amb eixos aleatòriament orientats i sense espícules.[73]
Les algues calcàries són un grup d'organismes sense validesa taxonòmica i, dins d'aquest grup, s'inclouen algues que precipiten carbonat càlcic (CaCO₃). Aquest tipus d'algues poden arribar a formar bioconstruccions carbonatades de certa mida.[74] Normalment el terme s'empra per a descriure algues bentòniques[75] i inclou espècies dels cloròfits (Chlorophyta), rodòfits (Rhodophyta), Phaeophyceae i cianobacteris.[76] Generalment, les cloròfites precipiten aragonita mentre que les rodòfites precipiten calcita rica en magnesi.[77] Els cianobacteris tenen un paper important en la precipitació de calcita en ambients lacustres, especialment en llacs oligotròfics.[78] Els serpúlids són una família d'anèlids sèssils constructors de tubs. Aquests tubs són exclusivament de material carbonatat com ara la calcita.[79] Els serpúlids són importants calcificadors, sobretot en mars temperats, on arriben a formar petits esculls.[79] Els serpúlids tenen un dels sistemes de biomineralització més avançats d'entre els anèlids i poden construir tubs de calcita, aragonita o mixtes.[79][80]
-
Ossicles d'holoturioïdeu (cogombre de mar) actual.
-
Esponja calcària fòssil del Juràssic
-
Arqueociat procedent de Nevada.
-
Halimeda fòssil
-
Halimeda actual (Mar Roig)
-
Penicillus (vores) i Halimeda (centre) actuals
-
Penicillus dumetosus actual (Bahames)
-
Protula tubularia, un serpúlid
Usos[modifica]

Les propietats de la calcita fan que sigui un mineral àmpliament utilitzat. S'utilitza com a material de construcció, abrasiu, pigment, en la indústria farmacèutica i altres.[81]
La indústria de la construcció és la principal indústria consumidora de calcita, sigui en forma de roca calcària o marbre.[81] Aquestes roques s'empren com a roques per a construcció o com a morter; s'han emprat des de fa milers d'anys. Els blocs de calcita són els principals materials de construcció en moltes piràmides d'Egipte i Amèrica Llatina. Actualment, la calcària polida i el marbre són materials de construcció; sobretot en arquitectura decorativa. La indústria actual utilitza la calcita per a produir ciment; el ciment s'utilitza per a construir edificis, carreteres, ponts, parets i altres estructures.[81] En el context de la construcció, la calcita també s'utilitza ornamentalment, ja sigui en forma de marbre, travertí o tova calcària. La calcita també és el component principal del guix (l'estri que s'utilitza per a dibuixar sobre les pissarres).[82]

La calcita també s'utilitza per a la neutralització d'àcids. Durant centenars d'anys. Les calcàries i els marbres s'han fragmentat i escampat pels camps com a neutralitzadors dels sòls. També s'escalfen per a produir una reacció més ràpida en el sòl. La calcita també s'empra com a neutralitzador en la indústria química, en àrees on els rius o corrents d'aigua es troben afectats per drenatge àcid de mines; distribuint-se en aquests corrents, la calcita ajuda a neutralitzar els àcids. El carbonat de calci derivat de calcàries o marbres d'alta puresa també s'utilitza en la medicina; barrejat amb sucre i potenciadors del gust, el carbonat forma pastilles mastegables per a neutralitzar els àcids de l'estómac.[81]

Diversos productes químics importants es produeixen també a partir de la calcita; sobretot diferents productes d'higiene domèstica com els detergents. També és emprada per a la fabricació de fertilitzants, metalls, vidre, gomes i cautxús, així com pintures. La varietat transparent coneguda com a espat d'Islàndia s'utilitza en la indústria òptica per a la fabricació de polaritzadors de microscopis i altres estris.

La calcita molta, anomenada blanc d'Espanya, s'utilitza com a abrasiu suau. A més, és un dels millors minerals per col·leccionar, ja que hi ha moltes formes interessants i variades, així com colorits i bonics espècimens. Són relativament fàcils d'identificar pels col·leccionistes a causa de la seva doble refracció i la seva reacció amb els àcids.
La calcita en forma de pols s'utilitza per a diferents propòsits. Quan s'utilitza en forma de pols, la calcita sovint presenta un marcat color blanc, i per tant s'utilitza com a pigment o com a emblanquinador; fins i tot, algunes pintures primitives van ser pintades a partir de pols de calcita. La pols extreta a partir de calcàries o marbres, és àmpliament utilitzada com a suplement en pinsos d'animals: les gallines ponedores i les vaques lleteres necessiten importants aportacions de calci per a mantenir la seva producció. La calcita, en ser un mineral de baixa duresa (3 en l'escala de Mohs), pot ser utilitzat com a abrasiu de baixa duresa, per a netejar superfícies sense fer-les malbé. La pols de calcària també pot ser aplicada sobre les parets i el sostre de mines de carbó per a reduir la pols derivada del carbó en l'aire (pols que comporta perill d'explosió); la pols de calcita no és inflamable i per tant redueix aquest risc.[81]
La calcita també pot ser utilitzada com a magatzem de diòxid de carboni. El diòxid de carboni és un gas que ajuda a atrapar i mantenir la calor a la superfície terrestre. Durant el procés de formació de calcita, part del diòxid de carboni s'elimina de l'atmosfera i s'emmagatzema durant llargs períodes; quan la calcita es meteoritza o s'utilitza per a alguns usos com ara la basificació d'aigües o la producció de ciment, aquest procés d'emmagatzematge del CO₂ es reverteix, per tant, la generació i destrucció de calcita té un important paper sobre el clima terrestre.[81]
Varietats[modifica]

Existeixen moltes varietats de calcita. Algunes d'aquestes varietats són conegudes per la seva forma cristal·lina, per les seves propietats, o bé per la seva composició química.
Pel que fa a la seva forma, una de les varietats més coneguda és l'anomenada calcita dent de gos, amb cristalls escalenoedres els quals presenten la forma dipiramidal semblant a les dents dels canins.[83] La calcita ales d'àngel és una varietat de calcita determinada tant per la forma dels cristalls com pel seu color. Els cristalls són grans, molt prims i tabulars, de color blanc, assemblant-se a les ales dels àngels. Generalment són més gruixuts a la base, i incolors a l'interior de les zones més gruixudes. Es tracta d'una varietat comuna de Mèxic.[84]
Pel que fa a les seves propietats, la varietat més coneguda és l'anomenat espat d'Islàndia, que són fragments de calcita totalment incolors i transparents. Va ser trobat per primer cop a cavitats basàltiques d'Islàndia i mostra amb molta claredat el fenomen de la birefringència o refracció doble, que fa que els objectes es vegin a través d'aquest apareguin doblats. A una longitud d'ona de ~590 nm la calcita té un índex de refracció ordinari i extraordinari d'1,658 i 1,486, respectivament.[85]
Un altre exemple de varietat prou coneguda és l'ònix mexicà, una varietat de calcita usada amb propòsits ornamentals que es talla amb facilitat en petites figures, gots i altres objectes comuns (no s'ha de confondre amb el veritable ònix, el qual és una varietat criptocristal·lina del quars).[86] Hi ha una varietat denominada tradicionalment alabastre que no s'ha de confondre amb la varietat de guix anomenada també alabastre. Tots dos tipus d'alabastre han estat utilitzats com a pedra ornamental a causa de la seva estructura de cristalls especialment fins susceptible de ser polida, amb un bel blanc translúcid. En aquesta varietat de calcita (sovint formada en ambients sedimentaris detrítics) els cristalls són molt petits (pràcticament invisibles a ull nu) formant un gran volum massiu de roca calcària.
La glendonita és una varietat de calcita pseudomòrfica després d'ikaïta, originària de Glendon (Nova Gal·les del Sud, Austràlia).[87] La ikaïta és una espècie mineral amb fórmula química CaCO₃·6H₂O força inestable, ja que es deshidrata a calcita per sobre dels 8 °C.[88] El gennoishi és una varietat de glendonita.[89]
Altres varietats de calcita són: afrita (una varietat molt suau de calcita),[90] antraconita (una varietat carbonífera negre, sovint bituminosa),[91] argentina o espat Schieffer (una varietat de calcita laminar amb lluentor platejada),[92] baricalcita (una varietat que conté bari, amb fórmula ((Ca,Ba)CO₃),[93] barleycorn (una varietat que consisteix en pseudomorfismes, possiblement de gaylussita),[94] bruyerita (una varietat concrecionària negre),[95] capreïta,[96] calcita cap de clau (una varietat amb una terminació piramidal plana dels cristalls prismàtics, assemblant-se a un cap de clau),[97] calcita cobàltica o cobaltocalcita (una varietat de color rosat a causa del seu contingut de Co2+),[98] calcita crispeta (una varietat de calcita que va cristal·litzar en petits nòduls; en trencar-se el material, les superfícies resultants s'assemblen a un munt de crispetes de blat de moro),[99] calcita dolomítica (una varietat que conté petites quantitats de magnesi en substitució del calci),[100] calcita estròncica (que conté estronci),[101] calcita fèrrica (que conté ferro),[102] calcita fitxa de pòquer (en anglès, poker chip calcite, una varietat determinada per la forma dels cristalls, és a dir, romboides plans que s'assemblen a una fitxa de pòquer; els cristalls són sovint apilats un sobre l'altre, fent que s'assembli també a una pila de fitxes de pòquer),[103] calcita magnèsica (una calcita rica en magnesi),[104] calcita mangànica o manganocalcita (una calcita rica en manganès),[105] calcita niquèlica (una varietat que conté níquel),[106] calcita plúmbica (que conté plom),[107] calcita-sorra (una varietat amb els cristalls crescuts amb inclusions de sorra),[108] calcita zíncica (varietat rica en zinc),[109] col·loïdcalcita (una varietat col·loidal),[110] crazy calcita (literalment calcita boja, nom que s'aplica en l'àmbit local en Nova Jersey a una calcita massiva que emet fluorescència en dues tonalitats i intensitats de vermell sota ona curta ultraviolada),[111] drewita,[112] espat pissarra (una varietat lamel·lar),[113] espat satinat (que no s'ha de confondre amb l'espat que és una varietat de guix),[114] hematoconita (una calcita de color vermell sang acolorida degut a les inclusions d'hematites),[115] hislopita,[116] lublinita (una forma eflorescent i suau de calcita, amb consistència fibrosa, i en generalment humida),[117] jade mexicà (una calcita de color verd tenyida artificialment),[118] patagosita,[119] pelagosita (una prima capa fosca sobre dolomita, possiblement formada per l'acció de l'aigua de mar),[120] prasocroma (rica en òxid de crom, que es troba com un recobriment producte d'alteració de la cromita),[121] prunnerita (una calcita violeta semblant a la calcedònia),[122] pseudogaylussita (calcita pseudomòrfica després de gaylussita),[123] roepperita,[124] stinkkalk (una varietat que es distingeix per desprendre una olor fètida en fracturar-la a causa d'inclusions d'H₂S),[125] i travertí (format per carbonat de calci dissolvent-lo en aigua subterrània i després dipositant-lo a la superfície de la terra pels rius, fonts naturals, o guèisers).[126]
-
Antraconita
-
Cobaltocalcita
-
Calcita fèrrica
-
Glendonita
-
Calcita mangànica
-
Calcita plúmbica
Referències[modifica]
- ↑ 1,0 1,1 1,2 1,3 «Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Calcite» (en anglès). Webmineral. [Consulta: 25 agost 2016].
- ↑ 3,0 3,1 «Calcite Group» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Transformation of aragonite to calcite through heating». Geochemical Journal, 19, 1985, pàg. 24–249.
- ↑ «Calcite» (en anglès). Online Ethimology Diccionary. [Consulta: 1r novembre 2014].
- ↑ More about alabaster and travertine, brief guide explaining the different use of the same terms by geologists, archaeologists and the stone trade. Oxford University Museum of Natural History, 2012 [1]
- ↑ «Strunz Table». [Consulta: 16 juny 2017].
- ↑ 8,0 8,1 Barcelona, Universidad de; (Barcelona), Fundació Folch. Atlas de asociaciones minerales en lámina delgada (en castellà). Edicions Universitat Barcelona, 2003. ISBN 9788447527632.
- ↑ Calcite
- ↑ 10,0 10,1 10,2 Tegethoff, F. Wolfgang. Calcium Carbonate: From the Cretaceous Period into the 21st Century (en anglès). Springer Basel AG, 2001, p. 341. ISBN 978-3-0348-9490-6.
- ↑ «Calcite Structure». Arxivat de l'original el 2017-10-20. [Consulta: 26 juny 2017].
- ↑ «Calcite Structures». Arxivat de l'original el 2017-06-01. [Consulta: 26 juny 2017].
- ↑ «Aragonite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Vaterite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Calcite-Rhodochrosite Series» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ http://www.gemdat.org/gem-859.html
- ↑ Elert, Glenn. «Refraction». The Physics Hypertextbook.
- ↑ 18,0 18,1 «CALCITE» (en anglès/francès). Database of luminiscent minerals. [Consulta: 24 agost 2016].
- ↑ 19,0 19,1 «Fluorescent Minerals» (en anglès). Geology.com. [Consulta: 24 agost 2016].
- ↑ «Geoscience Resources». [Consulta: 27 juny 2017].
- ↑ «Geology - rocks and minerals». [Consulta: 27 juny 2017].
- ↑ Diccionario de Arte II (en castellà). Barcelona: Biblioteca de Consulta Larousse. Spes Editorial SL (RBA), 2003, p.166. DL M-50.522-2002. ISBN 84-8332-391-5 [Consulta: 6 desembre 2014].
- ↑ «Calcita» (en castellà). Atlas de Rocas ígneas. Universidad Complutense de Madrid, 11-03-2013.
- ↑ «KIMBERLITAS,... - DEPSITOS EN KIMBERLITAS LAMPROITAS Y CARBONATITAS Depsitos de diamantes en kimberlitas y lamproitas Las Kimberlitas son rocas gneas» (en anglès). [Consulta: 27 juny 2017].
- ↑ «Ditroite: Ditroite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Busorite: Busorite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Calcite ijolite: Calcite ijolite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Cabytauite: Cabytauite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Calcite-carbonatite: Calcite-carbonatite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Damkjernite: Damkjernite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Calciocarbonatite lapillistone: Calciocarbonatite lapillistone mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Marble: Marble mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Calcite-bearing muscovite-chlorite schist: Calcite-bearing muscovite-chlorite schist mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Calcite-bearing muscovite-chlorite phyllite: Calcite-bearing muscovite-chlorite phyllite mineral information and data.». [Consulta: 22 maig 2017].
- ↑ «Search for Minerals in a Region (Alguer)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ 36,00 36,01 36,02 36,03 36,04 36,05 36,06 36,07 36,08 36,09 36,10 36,11 36,12 36,13 36,14 36,15 36,16 36,17 36,18 36,19 36,20 36,21 36,22 36,23 36,24 36,25 36,26 36,27 «Search for Minerals in a Region (Catalonia 1)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ 37,00 37,01 37,02 37,03 37,04 37,05 37,06 37,07 37,08 37,09 37,10 37,11 37,12 37,13 37,14 37,15 37,16 37,17 37,18 37,19 37,20 «Search for Minerals in a Region (Catalonia 1)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ 38,00 38,01 38,02 38,03 38,04 38,05 38,06 38,07 38,08 38,09 38,10 38,11 38,12 38,13 38,14 38,15 38,16 38,17 38,18 38,19 38,20 38,21 «Search for Minerals in a Region (Catalonia 1)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ «Search for Minerals in a Region (Illes Balears)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ «Pla director sectorial de carreteres (Illa de Mallorca). Annex 1: marc territorial. Geologia, orografia, hidrologia i climatologia.». Consell de Mallorca. [Consulta: 4 març 2013].
- ↑ «Search for Minerals in a Region (Aragon)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ 42,00 42,01 42,02 42,03 42,04 42,05 42,06 42,07 42,08 42,09 42,10 42,11 42,12 42,13 42,14 42,15 42,16 42,17 42,18 42,19 42,20 42,21 42,22 42,23 42,24 «Search for Minerals in a Region (Valencia 1)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ 43,00 43,01 43,02 43,03 43,04 43,05 43,06 43,07 43,08 43,09 43,10 43,11 43,12 «Search for Minerals in a Region (Valencia 2)» (en anglès). Mindat. [Consulta: 17 abril 2016].
- ↑ http://rruff.info/doclib/hom/calcite.pdf
- ↑ P. C. Rickwood «The largest crystals». American Mineralogist, 66, 1981, pàg. 885–907.
- ↑ «The giant crystal project site». Arxivat de l'original el 2009-05-12. [Consulta: 6 juny 2009].
- ↑ [2]
- ↑ 48,0 48,1 48,2 Porter, S. M. «Seawater Chemistry and Early Carbonate Biomineralization». Science, 316, 5829, 2007, pàg. 1302. DOI: 10.1126/science.1137284. PMID: 17540895.
- ↑ 49,0 49,1 Wilkinson, B.H., Owen, R.M., Carroll, A.R. «Submarine hydrothermal weathering, global eustacy, and carbonate polymorphism in Phanerozoic marine oolites». Journal of Sedimentary Petrology, 55, 1985, pàg. 171-183.
- ↑ Wilkinson, B.H., Given, K.R. «Secular variation in abiotic marine carbonates: constraints on Phanerozoic atmospheric carbon dioxide contents and oceanic Mg/Ca ratios». Journal of Geology, 94, 3, 1986, pàg. 321–333. Bibcode: 1986JG.....94..321W. DOI: 10.1086/629032.
- ↑ Morse, J.W., Mackenzie, F.T. «Geochemistry of sedimentary carbonates». Developments in Sedimentology, 48, 1990, pàg. 1–707. DOI: 10.1016/S0070-4571(08)70330-3.
- ↑ 52,0 52,1 Lowenstein, T.K., Timofeeff, M.N., Brennan, S.T., Hardie, L.A., Demicco, R.V. «Oscillations in Phanerozoic seawater chemistry: evidence from fluid inclusions». Science, 294, 5544, 2001, pàg. 1086-1088. Bibcode: 2001Sci...294.1086L. DOI: 10.1126/science.1064280. PMID: 11691988.
- ↑ 53,0 53,1 53,2 Palmer, T.J., Wilson, M.A. «Calcite precipitation and dissolution of biogenic aragonite in shallow Ordovician calcite seas». Lethaia, 37, 4, 2004, pàg. 417–427 [3]. DOI: 10.1080/00241160410002135.
- ↑ 54,0 54,1 Palmer, T.J. «Cambrian to Cretaceous changes in hardground communities». Lethaia, 15, 4, 1982, pàg. 309–323. DOI: 10.1111/j.1502-3931.1982.tb01696.x.
- ↑ 55,0 55,1 Harper, E.M.; Palmer, T.J.; Alphey, J.R. «Evolutionary response by bivalves to changing Phanerozoic sea-water chemistry». Geological Magazine, 134, 3, 1997, pàg. 403–407. DOI: 10.1017/S0016756897007061.
- ↑ Sandberg, P.A. «An oscillating trend in Phanerozoic non-skeletal carbonate mineralogy». Nature, 305, 5929, 1983, pàg. 19–22. Bibcode: 1983Natur.305...19S. DOI: 10.1038/305019a0.
- ↑ 57,0 57,1 Wilkinson, B.H., Given, K.R. «Secular variation in abiotic marine carbonates: constraints on Phanerozoic atmospheric carbon dioxide contents and oceanic Mg/Ca ratios». Journal of Geology, 94, 3, 1986, pàg. 321–333. Bibcode: 1986JG.....94..321W. DOI: 10.1086/629032.
- ↑ Cherns, L., Wright, V.P. «Missing molluscs as evidence of large-scale, early skeletal aragonite dissolution in a Silurian Sea». Geology, 28, 9, 2000, pàg. 791–794. Bibcode: 2000Geo....28..791C. DOI: 10.1130/0091-7613(2000)28<791:MMAEOL>2.0.CO;2.
- ↑ Wilkinson, B.H. «Biomineralization, paleooceanography, and the evolution of calcareous marine organisms». Geology, 7, 11, 1979, pàg. 524–527. Bibcode: 1979Geo.....7..524W. DOI: 10.1130/0091-7613(1979)7<524:BPATEO>2.0.CO;2.
- ↑ Stanley, S.M., Hardie, L.A. «Secular oscillations in the carbonate mineralogy of reef-building and sediment-producing organisms driven by tectonically forced shifts in seawater chemistry». Palaeogeography, Palaeoclimatology, Palaeoecology, 144, 1-2, 1998, pàg. 3-19. DOI: 10.1016/S0031-0182(98)00109-6.
- ↑ 61,0 61,1 Stanley, S.M., Hardie, L.A. «Hypercalcification; paleontology links plate tectonics and geochemistry to sedimentology». GSA Today, 9, 1999, pàg. 1–7.
- ↑ 62,0 62,1 «Fossilization - How Fossils Form» (en anglès). Fossil Museum. [Consulta: 25 agost 2016].
- ↑ Su, X.; Kamat, S.; Heuer, H. «The structure of sea urchin spines, large biogenic single crystals of calcite». JOURNAL OF MATERIALS SCIENCE, 2000, pàg. 5545 – 5551.
- ↑ Behrens, Peter; Bäuerlein, Edmund. Handbook of Biomineralization: Biomimetic and Bioinspired Chemistry. John Wiley and Sons, 2009, p. 393. ISBN 3527318054.
- ↑ Pujade-Villar, Juli; Selfa Arlandis, Jesús; Pujade i Villar, Juli. Fonaments de zoologia dels artròpodes. València: Universitat de València, 2002, p. 196. ISBN 84-370-5361-7.
- ↑ Wilmot, N. V.; Fallick, A. E. «Original Mineralogy of Trilobite Exoeskeletons». Palacontology, 1989, pàg. 297-304. Arxivat de l'original el 2015-10-20 [Consulta: 6 desembre 2016]. Arxivat 2015-10-20 a Wayback Machine.
- ↑ Williams, Vernon L. «Evolution and the Calcite Eye Lens» (en anglès). (-).
- ↑ 68,0 68,1 68,2 «Morfología de los Trilobites» (en castellà). Asturnatura. Arxivat de l'original el 2020-11-23. [Consulta: 6 desembre 2016].
- ↑ Qiao, L.; Feng, Q. L.; Li, Z. «Special vaterite found in freshwater lackluster pearls». Cryst.Growth, 2007, pàg. 275-279..
- ↑ 70,0 70,1 70,2 Furuhashi, Takeshi; Schwarzinger, Clemes; Miksik, Ivan; Smrz, Miloslav; Beran, Anton «Molluscan shell evolution with review of shell calcification hypothesis». Comparative Biochemistry and Physiology, Part B, 2009, pàg. 351-371.
- ↑ 71,0 71,1 71,2 Sethmann, I.; Wörheide, G. «Structure and composition of calcareous sponge spicules: a review and comparison to structurally related biominerals.». PubMed, 2008, pàg. 209-228.
- ↑ Stock, C. W. «Stromatoporoidea». Journal of Paleontology, 2001, pàg. 1079-1089.
- ↑ «Archaeocyatha: More on Morphology» (en anglès). [Per als editors, consulteu: http://www.ucmp.berkeley.edu/porifera/auporifera.html]. [Consulta: 6 desembre 2016].
- ↑ (Wray 1977, p. 1)
- ↑ Red IRIS. «Recent and fossil calcareous algae», 31-05-2000. [Consulta: 15 abril].
- ↑ (Riding 2011, p. 211)
- ↑ Basso, D. y Granier, B. «Calcareous algae in changing environments». Geodiversitas. Muséum national d'Histoire naturelle, 34, 1, 2012, pàg. 5-11. ISSN: 1280-9659.
- ↑ Obst, M.; Dittrich, M. «Calcite Precipitation by Cyanobacteria». Geophysical Research Abstracts, 2005.
- ↑ 79,0 79,1 79,2 Vinn, O. «Occurrence, Formation and Function of Organic Sheets in the Mineral Tube Structures of Serpulidae (Polychaeta, Annelida)». Australian Museum, Australia. Donald James Colgan, Australian Museum, 2013.
- ↑ Vinn, Olev; Kirsimäe, Kalle; ten Hove, A. «Tube ultrastructure of Pomatoceros americanus (Polychaeta, Serpulidae): implications for the tube formation of serpulids». Estonian Journal of Earth Sciences, 2009, pàg. 148-152.
- ↑ 81,0 81,1 81,2 81,3 81,4 81,5 «Calcite» (en anglès). Geology.com. [Consulta: 28 agost 2016].
- ↑ «Calcite» (en anglès). Minerals.net. [Consulta: 8 maig 2016].
- ↑ «Dog-tooth Spar» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Angels Wing Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ Elert, Glenn. «Refraction». The Physics Hypertextbook.
- ↑ «Limestone Onyx» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Glendonite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Ikaite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Gennoishi» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Aphrite (of Karsten)» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Anthraconite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Argentine» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Baricalcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Barleycorn» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Bruyerite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Capreite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Nailhead Spar» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Cobaltoan Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Popcorn Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Dolomitic Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Strontian Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Ferroan Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Poker Chip Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Mg-rich Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Manganoan Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Nickeloan Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Plumboan Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Sand-Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Zincian Calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Kolloid-calcite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Crazy Calcite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Drewite» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Slate Spar» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Calcite Satin Spar» (en anglès). Mindat. [Consulta: 1r novembre 2014].
- ↑ «Hematoconite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Hislopite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Lublinite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Mexican Jade» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Patagosite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Pelagosite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Prasochrome» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Prunnerite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Pseudogaylussite» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Roepperite (of Kenngott)» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Stinkkalk» (en anglès). Mindat. [Consulta: 2 novembre 2014].
- ↑ «Travertine» (en anglès). Mindat. [Consulta: 2 novembre 2014].
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Calcita |